题目内容
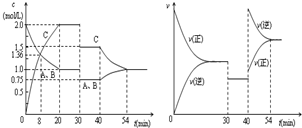
 某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应是:A(g)+xB(g)?2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如图所示.下列说法中正确是( )
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应是:A(g)+xB(g)?2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如图所示.下列说法中正确是( )分析:该题为化学平衡图象题.解化学平衡图象题,看图象:一看轴,弄清横坐标和纵坐标的意义.二看点,弄清图象上点的意义,看起点,交点,转折点,终点.三看量的变化,利用相关公式进行计算.
解答:解:根据解化学平衡图象题的技巧,从该题图1可知,0-20min是反应:A(g)+xB(g) 2C(g),达到平衡的过程,20min时各浓度保持不变,达平衡.从该题图2可知,30-40min,改变条件后,平衡不移动,反应速率减慢,40-54min,达新平衡.
2C(g),达到平衡的过程,20min时各浓度保持不变,达平衡.从该题图2可知,30-40min,改变条件后,平衡不移动,反应速率减慢,40-54min,达新平衡.
A.从图2可知,30min时正反应速率和逆反应速率同时降低.降低反应温度,正反应速率和逆反应速率同时降低,但降低反应温度,平衡向放热反应方向移动.该反应无论正反应方向放热还是吸热,平衡均移动与图2中30-40min,改变条件后,平衡不移动矛盾.故A错误.
B.催化剂的作用是:能改变其他物质的化学反应速率,而本身的质量和化学性质在化学反应前后都没有发生改变.使用催化剂不可以提高反应物的转化率,仅改变化学反应速率.故B错误.
C.当反应A(g)+xB(g) 2C(g),反应方程式中的x=1时,反应前后气体总的量不变.压强改变,平衡不移动.图2中30-40min,平衡不移动,此时图1中30-40min,A、B的浓度在减少,C的浓度在增加.显示平衡向正反应方向移动与压强改变,平衡不移动矛盾;正反应为吸热反应,在其它条件不变时,升高反应温度,有利于吸热反应,平衡向吸热反应方向移动,即平衡向正反应方向移动,升高反应温度,反应速率加快与图2中30-40min正反应速率和逆反应速率同时降低矛盾.故C错误.
2C(g),反应方程式中的x=1时,反应前后气体总的量不变.压强改变,平衡不移动.图2中30-40min,平衡不移动,此时图1中30-40min,A、B的浓度在减少,C的浓度在增加.显示平衡向正反应方向移动与压强改变,平衡不移动矛盾;正反应为吸热反应,在其它条件不变时,升高反应温度,有利于吸热反应,平衡向吸热反应方向移动,即平衡向正反应方向移动,升高反应温度,反应速率加快与图2中30-40min正反应速率和逆反应速率同时降低矛盾.故C错误.
D.从图1可知,8min前v(A)=
=
mol=0.08mol,逆反应:v(c)=
=
mol=0.17mol,根据同一反应,A(g)+xB(g) 2C(g),正反应v(A)和逆反应v(c),v(A):v(c)═1:2,正反应速率大于逆反应速率,故D正确.
2C(g),正反应v(A)和逆反应v(c),v(A):v(c)═1:2,正反应速率大于逆反应速率,故D正确.
故正确答案为D.
 2C(g),达到平衡的过程,20min时各浓度保持不变,达平衡.从该题图2可知,30-40min,改变条件后,平衡不移动,反应速率减慢,40-54min,达新平衡.
2C(g),达到平衡的过程,20min时各浓度保持不变,达平衡.从该题图2可知,30-40min,改变条件后,平衡不移动,反应速率减慢,40-54min,达新平衡.A.从图2可知,30min时正反应速率和逆反应速率同时降低.降低反应温度,正反应速率和逆反应速率同时降低,但降低反应温度,平衡向放热反应方向移动.该反应无论正反应方向放热还是吸热,平衡均移动与图2中30-40min,改变条件后,平衡不移动矛盾.故A错误.
B.催化剂的作用是:能改变其他物质的化学反应速率,而本身的质量和化学性质在化学反应前后都没有发生改变.使用催化剂不可以提高反应物的转化率,仅改变化学反应速率.故B错误.
C.当反应A(g)+xB(g)
 2C(g),反应方程式中的x=1时,反应前后气体总的量不变.压强改变,平衡不移动.图2中30-40min,平衡不移动,此时图1中30-40min,A、B的浓度在减少,C的浓度在增加.显示平衡向正反应方向移动与压强改变,平衡不移动矛盾;正反应为吸热反应,在其它条件不变时,升高反应温度,有利于吸热反应,平衡向吸热反应方向移动,即平衡向正反应方向移动,升高反应温度,反应速率加快与图2中30-40min正反应速率和逆反应速率同时降低矛盾.故C错误.
2C(g),反应方程式中的x=1时,反应前后气体总的量不变.压强改变,平衡不移动.图2中30-40min,平衡不移动,此时图1中30-40min,A、B的浓度在减少,C的浓度在增加.显示平衡向正反应方向移动与压强改变,平衡不移动矛盾;正反应为吸热反应,在其它条件不变时,升高反应温度,有利于吸热反应,平衡向吸热反应方向移动,即平衡向正反应方向移动,升高反应温度,反应速率加快与图2中30-40min正反应速率和逆反应速率同时降低矛盾.故C错误.D.从图1可知,8min前v(A)=
| C(A) |
| t |
| 2-1.36 |
| 8 |
| c(c) |
| t |
| 1.36-0 |
| 8 |
 2C(g),正反应v(A)和逆反应v(c),v(A):v(c)═1:2,正反应速率大于逆反应速率,故D正确.
2C(g),正反应v(A)和逆反应v(c),v(A):v(c)═1:2,正反应速率大于逆反应速率,故D正确.故正确答案为D.
点评:该题涉及化学平衡移动的影响因素和化学反应速率的有关计算.需读懂化学平衡的图象、正确理解平衡移动的本质是因正反应速率和逆反应改变的程度不同.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目