题目内容
现有0.1 mol·L-1的AlCl3溶液和0.1 mol·L-1的氢氧化钠溶液,进行下面的实验。?(1)在试管中盛有上述AlCl3溶液10 mL,向其中逐渐滴入上述的NaOH溶液。?
①加入10 mL NaOH溶液时的现象是__________________,加入30 mL NaOH溶液时的现象是___________________,加入35 mL NaOH溶液时的现象是____________。?
②生成沉淀质量最多时,需NaOH溶液_________mL。?
(2)向盛有10 mL NaOH溶液的试管中滴入AlCl3溶液,同时不停摇动试管,出现的现象是__________________,至加入多少毫升AlCl3溶液时开始出现沉淀?_______________,至加入多少毫升AlCl3溶液时沉淀量最多?____________。?
解析:(1)当NaOH溶液滴入10 mL 0.1 mol·L-1 AlCl3溶液中时,整个过程可用图象表示如下:?
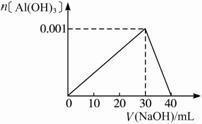 ?
?
因为![]() (Al3+)=0.1 mol·L-1×10 mL×10
(Al3+)=0.1 mol·L-1×10 mL×10
(2)当AlCl3溶液滴入NaOH溶液时,由于NaOH溶液是过量的,所以反应如下:Al3++3OH-![]() Al(OH)3↓,Al(OH)3+OH-
Al(OH)3↓,Al(OH)3+OH-![]()
![]() +2H2O?
+2H2O?
上述两个方程式合并为:Al3++4OH-![]()
![]() +2H2O, 3
+2H2O, 3![]() +Al3++6H2O
+Al3++6H2O![]() 4Al(OH)3↓?
4Al(OH)3↓?
可用图象表示如下:?
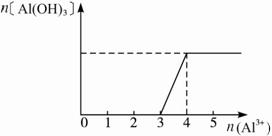 ?
?
由于第一过程消耗的Al3+与第二过程消耗的Al3+之比为3∶1,故开始产生沉淀与沉淀到最大所耗AlCl3溶液的体积比为3∶1。?
故开始时,现象为:有沉淀生成,但振荡后马上消失,开始沉淀时,需加入AlCl3的体积为![]() 。?
。?
因为Al3+? ~ 4OH- ~ ![]() ?
?
1 4 1?
0.1![]() ? 0.1×0.001×10?
? 0.1×0.001×10?
?![]() =2.5 mL?
=2.5 mL?
所以生成![]() 为2.5×0.1×10-3 mol=2.5×10-4 mol?
为2.5×0.1×10-3 mol=2.5×10-4 mol?
生成的![]() 转化为Al(OH)3需Al3+的物质的量为
转化为Al(OH)3需Al3+的物质的量为![]() 。?
。?
3![]() ~ Al3+??
~ Al3+??
3 1?
2.5×10-4 mol? ![]() ??
??
?![]() =
=![]() mol?
mol?
沉淀最多时,需加入AlCl3的体积为![]() mol÷0.1 mol·L-1×1 000 mL·L-1+2.5 mL=
mol÷0.1 mol·L-1×1 000 mL·L-1+2.5 mL=![]() mL
mL
答案:(1)①产生白色沉淀 沉淀量最多 沉淀部分溶解 ②30 (2)有沉淀生成,但振荡后马上消失?2.5 mL 10/3 mL

 阅读快车系列答案
阅读快车系列答案(8分)(1)现有0.1 mol·L-1的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作是________________________________________________________________________
________________________________________________________________________________________________________________________________________________;
纯碱溶液呈碱性的原因是(用离子方程式表示)__________________________________ ______________________________________。
(2)为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案:________ ________________________________________。
(3)为证明盐的水解是吸热反应,四位学生分别设计了如下方案,其中正确的是________。
| A.甲学生:在醋酸钠溶液中滴入2滴酚酞,加热后红色加深,说明盐类水解是吸热反应 |
| B.乙学生:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热反应 |
| C.丙学生:将硝酸铵晶体溶于水,水温下降,说明盐类水解是吸热反应 |
| D.丁学生:在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热反应 |