题目内容
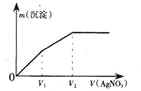
【题目】25 ℃时,将一定量的冰醋酸(即无水乙酸)加水稀释,稀释过程中溶液的导电性变化如图所示。则下列说法不正确的是( )

A. 醋酸的电离程度:a<b<c
B. 溶液中c(H+):b>a>c
C. a、b、c三点的溶液都有c(H+)=c(CH3COO-)+c(OH-)
D. 从b点到c点,溶液中![]() 的比值减小
的比值减小
【答案】D
【解析】弱电解质溶液越稀,电离程度越大,所以醋酸电离程度a<b<c,故A正确;导电能力越大,离子浓度越大,所以溶液中c(H+):b>a>c,故B正确;根据电荷守恒,a、b、c三点的溶液都有c(H+)=c(CH3COO-)+c(OH-),故C正确;根据![]() 不变, 从b点到c点氢离子浓度减小,所以溶液中
不变, 从b点到c点氢离子浓度减小,所以溶液中![]() 的比值增大,故D错误。
的比值增大,故D错误。

练习册系列答案
相关题目
【题目】在恒温、恒容条件下发生下列反应:2X2O5 (g) ![]() 4XO2(g) +O2(g) △H>0,T温度下的部分实验数据为:
4XO2(g) +O2(g) △H>0,T温度下的部分实验数据为:
t/s | 0 | 50 | 100 | 150 |
c(X2O5) mol/L | 4.00 | 2.50 | 2.00 | 2.00 |
下列说法错误的是
A. T温度下的平衡数为K=64 (mol/L)3,100s时转化率为50%
B. 50s 内 X2O5分解速率为 0.03 mol/ (Ls)
C. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则Kl>K2
D. 若只将恒容改为恒压,其它条件都不变,则平衡时X2O5的转化率和平衡常数都不变