题目内容
(三选一)【选修3:物质结构与性质】
铬是人体必需的微量元素,在维持人体健康方面起关键作用。
(1)Cr元素基态原子的电子排布式为________。
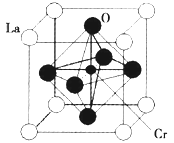
(2)某镧(La)铬(Cr)型复合氧化物具有巨磁电阻效应,晶胞结构如图所示,则其化学式为_________。
铬是人体必需的微量元素,在维持人体健康方面起关键作用。
(1)Cr元素基态原子的电子排布式为________。
(2)某镧(La)铬(Cr)型复合氧化物具有巨磁电阻效应,晶胞结构如图所示,则其化学式为_________。
(3)Cr3+能与Cl-、CN-、H2O等形成配位数为6的配合物。
①[Cr(H2O)4Cl2]Cl·H2O中存在的化学键类型有________,配位体H2O分子中O 原子的杂化类型为_________。
②K3[Cr(CN)6]中C、N、O的第一电离能由大到小的顺序为____________,CN-中提供孤电子对的元素是______,与CN-互为等电子体的微粒有_________、_________等。
①[Cr(H2O)4Cl2]Cl·H2O中存在的化学键类型有________,配位体H2O分子中O 原子的杂化类型为_________。
②K3[Cr(CN)6]中C、N、O的第一电离能由大到小的顺序为____________,CN-中提供孤电子对的元素是______,与CN-互为等电子体的微粒有_________、_________等。
(1)1s22s22p63s23p63d54s1或[Ar]3d54s1
(2)LaCrO3
(3)①离子键、配位键、极性共价键;sp3;②N>O>C;N;N2;CO
(2)LaCrO3
(3)①离子键、配位键、极性共价键;sp3;②N>O>C;N;N2;CO

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案
相关题目