题目内容
在无色透明的强碱性溶液中,下列各组离子能大量共存的是( )
| A.K+、 Ba2+、Cl—、NO3— | B.Na+、Cu2+、SO42—、NO3— |
| C.Mg2+、Na+、SO42—、Cl— | D.Na+、K+、NH4+、Cl— |
A
解析试题分析:解离子共存问题注意:(1)离子之间能反应不能大量共存,反应有四类:①复分解反应:生成气体、沉淀、难电离的物质,②氧化还原反应③相互促进的水解反应④络合反应;(2)注意题目中的隐含条件:颜色、酸碱性等。此题中无色透明的强碱性溶液,有色离子不能大量存在且溶液中含有大量氢氧根。A、K+、 Ba2+、Cl-、 NO3-在题给条件下不反应,能大量共存,正确;B、Cu2+在水溶液中显蓝色,碱性条件下Cu2+和OH-反应生成Cu(OH)2沉淀,不能大量共存,错误;C、碱性条件下Mg2+和OH-反应生成Mg(OH)2沉淀,不能大量共存,错误;D、碱性条件下NH4+和OH-反应生成NH3·H2O弱电解质,不能大量共存,错误。
考点:考查离子大量共存问题。

练习册系列答案
相关题目
下列对对应现象的描述与离子方程式都正确的是( )
| A.金属镁与稀盐酸反应:有气体生成,Mg+2H++2Cl-=MgCl2+H2↑ |
| B.氯化钡溶液与硫酸反应:有白色沉淀生成:SO42-+Ba2+ =BaSO4↓ |
| C.碳酸钠溶液与盐酸反应:有气泡逸出:Na2CO3+2H+=2Na++CO2↑+H2O |
| D.过量铁粉与氯化铜溶液反应:溶液南蓝色变成浅绿色,同时有红色固体生成:Fe+Cu2+=Fe3++Cu |
下列各组离子在指定溶液中能大量共存的是
| A.常温下,呈碱性的溶液:K+、AlO2-、CO32-、Na+ |
| B.含Fe3+的溶液中:K+、NH4+、Cl-、I- |
| C.中性溶液:Fe3+、Al3+、NO3-、SO42- |
| D.无色溶液中:K+、AlO2-、NO3-、HCO3- |
下列各组离子在指定环境中一定能大量共存的是 ( )
| A.使pH试纸显蓝色的溶液中:Cu2+、NO3-、Fe3+、SO42- |
| B.与铝粉反应放出氢气的无色溶液中:NO3-、Al3+、Na+、SO42- |
| C.使红色石蕊试纸变蓝的溶液中:SO32-、CO32-、Na+、K+ |
| D.pH=0的溶液中:Al3+、NH4+、Ca2+、ClO- |
电解质是
| A.导电性很强的物质 | B.在水溶液里或熔融状态下能导电的化合物 |
| C.可溶性盐类 | D.在水溶液里和熔融状态下能导电的化合物 |
某同学在实验室中进行如下实验:
| 编号 | I | II | III |
| 实验 | 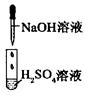 |  | 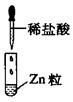 |
| 现象 | 没有明显变化,溶液仍为无色 | 有白色沉淀生成,溶液为蓝色 | 有无色气体放出 |
A.I中混合前后溶液中各离子种类、个数均不变
B.II中反应前后溶液中Cu2+、Cl-浓度均未变
C.II中BaCl2替换为Ba(NO3)2溶液,发生的离子反应相同
D.III中发生的反应属于置换反应,不属于离子反应
下列离子方程式正确的是
| A.氯气通入水中 :Cl2+H2O=2H++Cl-+ClO- |
| B.向Fe(OH)3中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| C.向Fe(NO3)2稀溶液中加入盐酸:Fe2++4H++NO3-=Fe3++NO↑+2H2O |
| D.向NaHCO3溶液中加入少量的Ba(OH)2溶液:Ba2++2HCO3-+2OH-= BaCO3↓+CO32-+2H2O |
下列在溶液中各组反应,可用同一离子方程式表示的是( )
| A.氢氧化钠与盐酸;氢氧化钾与碳酸 |
| B.Na2CO3溶液与KHSO4溶液;K2CO3溶液与HCl溶液 |
| C.MgCl2溶液与NaOH溶液;Ba(OH)2溶液与MgSO4溶液 |
| D.氧化钠与稀盐酸混合;氧化铜与稀盐酸 |
 ,Na+,HSO
,Na+,HSO ,PO
,PO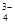 ,MnO
,MnO
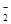 ,NO
,NO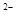 ,SO
,SO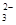
 ,CO
,CO ,Cl
,Cl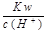 ="0.1" mol/L的溶液中:Na+,K+,SO
="0.1" mol/L的溶液中:Na+,K+,SO