题目内容
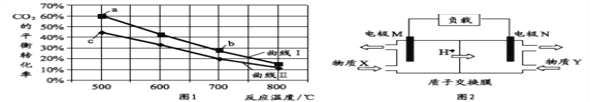
【题目】甲醇是重要的化工原料和燃料。将CO2与含少量CO的H2混合,在恒容密闭容器中发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),图1是在两种投料比[c(CO2)/c(H2+CO)]分别为1:4 和1:6 时,CO2平衡转化率随温度变化的曲线,图2 是生成的甲醇/过氧化氢燃料电池的工作原理示意图:
下列有关说法正确的是( )
A. 图2中电极M上发生还原反应
B. 图2中电极N的反应式:H2O2+2e+2H+=2H2O
C. 图1中b点对应的平衡常数K值大于c点
D. 图1中a点对应的H2的转化率等于30%
【答案】B
【解析】A. 图2中H+的移动方向是逆时针方向,相反,电子的移动方向是顺时针方向,所以电极M作负极而发生氧化反应,故A错误;B. 图2中电极N作正极而发生还原反应,电极反应式:H2O2+2e+2H+=2H2O,故B正确;C. 图1中CO2平衡转化率随温度升高而减小,表明升温平衡左移,该反应为放热反应,所以b点温度较高,对应的平衡常数K值小于c点,故C错误;D. 图1中a点对应H2和CO的投料比不确定,对应的H2的转化率无从确定,故D错误。故选B。

练习册系列答案
相关题目


