题目内容
铜与浓硝酸反应的化学方程式如下:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O将 3.2g铜完全溶于足量的 50mL 11.0mol?L-1 的浓硝酸中,只生成NO2气体,假设反应后溶液的体积仍为 50mL.试计算:(1)反应后可生成标准状况下NO2气体多少L?(写计算过程)
(2)反应后溶液中NO3-物质的量浓度为 .
【答案】分析:(1)根据n=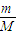 计算铜的质量,再根据方程式计算生成的NO2的物质的量,根据V=nVm计算NO2的体积;
计算铜的质量,再根据方程式计算生成的NO2的物质的量,根据V=nVm计算NO2的体积;
(2)根据氮元素守恒,反应后溶液中n(NO3-)=n原(HNO3)-n(NO2),再根据c=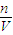 计算.
计算.
解答:解:(1)3.2g铜的物质的量为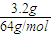 =0.05mol,则:
=0.05mol,则:
Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
1 2
0.05mol 0.1mol
故NO2的体积为:0.1mol×22.4L/mol=2.24L,
答:生成的NO2的体积为2.24L;
(2)50mL 11.0mol?L-1 的浓硝酸中n(HNO3)=0.05L×11.0mol?L-1=0.55mol,
故反应后溶液中n(NO3-)=n原(HNO3)-n(NO2)=0.55mol-0.1mol=0.45mol,
故反应后溶液中c(NO3-)=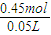 =9mol/L,
=9mol/L,
故答案为:9mol/L.
点评:考查根据方程式的计算,难度不大,注意(2)中根据氮原子守恒的利用.
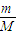 计算铜的质量,再根据方程式计算生成的NO2的物质的量,根据V=nVm计算NO2的体积;
计算铜的质量,再根据方程式计算生成的NO2的物质的量,根据V=nVm计算NO2的体积;(2)根据氮元素守恒,反应后溶液中n(NO3-)=n原(HNO3)-n(NO2),再根据c=
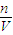 计算.
计算.解答:解:(1)3.2g铜的物质的量为
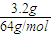 =0.05mol,则:
=0.05mol,则:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
1 2
0.05mol 0.1mol
故NO2的体积为:0.1mol×22.4L/mol=2.24L,
答:生成的NO2的体积为2.24L;
(2)50mL 11.0mol?L-1 的浓硝酸中n(HNO3)=0.05L×11.0mol?L-1=0.55mol,
故反应后溶液中n(NO3-)=n原(HNO3)-n(NO2)=0.55mol-0.1mol=0.45mol,
故反应后溶液中c(NO3-)=
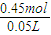 =9mol/L,
=9mol/L,故答案为:9mol/L.
点评:考查根据方程式的计算,难度不大,注意(2)中根据氮原子守恒的利用.

练习册系列答案
相关题目
 (1)铜与浓硝酸反应的化学方程式:_______________________;
(1)铜与浓硝酸反应的化学方程式:_______________________;