题目内容
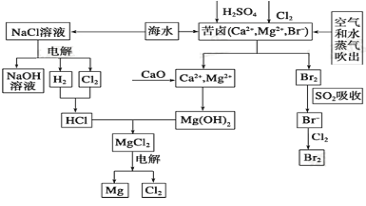
【题目】海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料。下图是海水综合利用的部分流程图,据图回答问题:
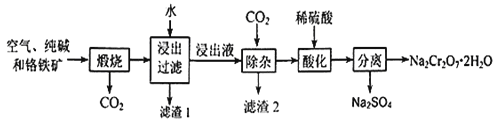
(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式) _____________________。
(2)①目前较先进的电解制碱法是离子交换膜电解法,即用阳离子交换膜把电解槽隔成阴极室和阳极室,其作用是______________,电解饱和食盐水的化学反应方程式为_____________。
②制取MgCl2的过程中涉及反应:MgCl2·6H2O![]() MgCl2+6H2O,该反应要在HCl气氛中进行,其原因是_____________________。
MgCl2+6H2O,该反应要在HCl气氛中进行,其原因是_____________________。
(3)苦卤中先通入Cl2置换出Br2 ,为什么吹出后用SO2吸收转化为Br-再用Cl2置换,其理由是_________,由此判断Cl2、Br2、SO2的氧化性由强到弱的顺序为_______________。
(4)也有工艺是在吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出。该反应的离子方程式是_____________;最后再用H2SO4处理得到Br2 ,之后加入CCl4进行Br2的萃取,最终用_____________方法得到单质Br2。
【答案】
(1)BaCl2、NaOH、Na2CO3、HCl;
(2)①阻止H2与Cl2发生反应甚至发生爆炸或阻止Cl2与生成的NaOH溶液反应而使烧碱产品不纯;2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH;②防止MgCl2水解;
Cl2↑+H2↑+2NaOH;②防止MgCl2水解;
(3)第一次吹出的Br2浓度太低,分离浪费原料,SO2吸收主要起到富集作用;Cl2>Br2>SO2
(4)3Br2+3CO32-═5Br-+BrO-3+3CO2↑;蒸馏
【解析】
试题分析:(1)SO42-、Ca2+、Mg2+等分别与BaCl2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的BaCl2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加BaCl2溶液再加Na2CO3溶液,最后加入盐酸,所以正确顺序为:BaCl2、NaOH、Na2CO3、HCl,故答案为:BaCl2、NaOH、Na2CO3、HCl;
(2)①阳离子交换膜只能阳离子通过,阴离子和气体不能通过,用石墨作电解电解饱和氯化钠时,阳极上氯离子放电生成氯气,氯气不能通过阳离子交换膜而进入阴极,如果氯气进入阴极易和氢气混合产生爆炸,且易和氢氧化钠溶液反应生成氯化钠、次氯酸钠而导致制取的氢氧化钠不纯,电解饱和食盐水反应的化学方程式为:2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH,故答案为:阻止H2与Cl2发生反应甚至发生爆炸或阻止Cl2与生成的NaOH溶液反应而使烧碱产品不纯; 2NaCl+2H2O
Cl2↑+H2↑+2NaOH,故答案为:阻止H2与Cl2发生反应甚至发生爆炸或阻止Cl2与生成的NaOH溶液反应而使烧碱产品不纯; 2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH;
Cl2↑+H2↑+2NaOH;
②氯化镁在水中乙发生水解,为抑制水解,氯化镁晶体应在氯化氢气流中脱水,故答案为:在HCl气流中加热脱水(防止MgCl2水解);故答案为:防止MgCl2水解;
(3)苦卤中通入Cl2已经置换出Br2,吹出后用SO2吸收转化为Br-再用Cl2置换是为了富集溴元素,第一次吹出的Br2浓度太低,分离浪费原料,SO2吸收主要起到富集作用,在自发进行的氧化还原反应中,还原剂的还原性大于还原产物的还原性,氧化剂氧化性大于氧化产物,Cl2+2Br-=Br2+2Cl-中还原性 Br->Cl-,SO2+2H2O+Br2=H2SO4+2HBr中还原性SO2>Br-,所以还原性强弱顺序是 SO2>Br->Cl-,氧化性强弱顺序为:Cl2>Br2>SO2,故答案为:第一次吹出的Br2浓度太低,分离浪费原料,SO2吸收主要起到富集作用 Cl2>Br2>SO2
(4)吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出,反应的离子方程式为:3Br2+3CO32-═5Br-+BrO-3+3CO2↑,生成溴化钠和溴酸钠,最后再用H2SO4处理得到Br2,加入CCl4进行Br2的萃取最后通过蒸馏操作分离得到溴单质,故答案为:3Br2+3CO32-═5Br-+BrO-3+3CO2↑;蒸馏。

 名校课堂系列答案
名校课堂系列答案