题目内容
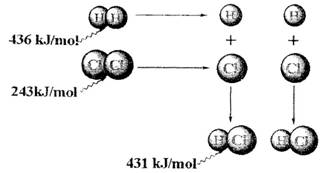
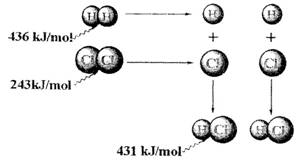
 根据图中包含的信息分析,下列叙述正确的是( )
根据图中包含的信息分析,下列叙述正确的是( )分析:由图知:断开1molH2中的H-H键需要吸收436kJ的能量,生成1molHCl中的H-Cl键需要放出431kJ的能量,反应生成2mol氯化氢气体放出的热量:431kJ/mol×2mol-436kJ/mol-248kJ/mol=183kJ/mol.
解答:解:A.反应生成2mol氯化氢气体放出的热量:431kJ/mol×2mol-436kJ/mol-248kJ/mol=183kJ/mol,故A错误;
B.436kJ/mol是指断开1molH2中的H-H键需要吸收436kJ的能量,故B错误;
C.反应生成2mol氯化氢气体放出的热量:431kJ/mol×2mol-436kJ/mol-248kJ/mol=183kJ/mol,故C正确;
D.431kJ/mol是指生成1molHCl中的H-Cl键需要放出431kJ的能量,故D错误.
故选C.
B.436kJ/mol是指断开1molH2中的H-H键需要吸收436kJ的能量,故B错误;
C.反应生成2mol氯化氢气体放出的热量:431kJ/mol×2mol-436kJ/mol-248kJ/mol=183kJ/mol,故C正确;
D.431kJ/mol是指生成1molHCl中的H-Cl键需要放出431kJ的能量,故D错误.
故选C.
点评:本题考查化学反应中键能与能量变化的关系,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
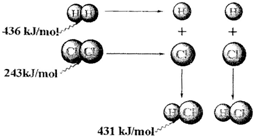
根据图中包含的信息分析,下列叙述正确的是( )
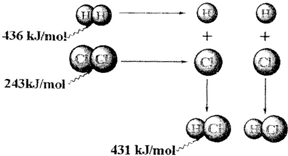

| A、氢气与氯气反应生成1mol氯化氢气体,反应的△H=+248kJ/mol | B、436 kJ/mol是指断开1 mol H2中的H-H键需要放出436 kJ的能量 | C、氢气与氯气反应生成2mol氯化氢气体,反应的△H=-183kJ/mol | D、该反应的热化学方程式是H2(g)+Cl2(g)═2HCl(g)△H=+183kJ/mol |
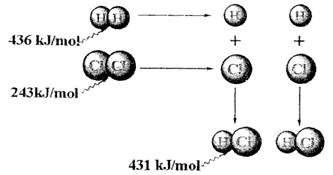
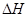 =+248kJ/mol
=+248kJ/mol