题目内容
在一定条件下,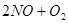

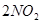 达到平衡的标志是
达到平衡的标志是
| A.NO、O2、NO2分子数目比是2:1:2 |
| B.反应混合物中各组分物质的浓度相等 |
| C.混合气体的颜色不再变化 |
| D.混合气体的平均相对分子质量改变 |
C
解析

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
题目内容
在一定条件下,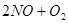

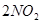 达到平衡的标志是
达到平衡的标志是
| A.NO、O2、NO2分子数目比是2:1:2 |
| B.反应混合物中各组分物质的浓度相等 |
| C.混合气体的颜色不再变化 |
| D.混合气体的平均相对分子质量改变 |
C
解析

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案