题目内容
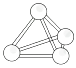
【题目】金晶体是面心立方体,立方体的每个面上5个金原子紧密堆砌(如图,其余各面省略),金原子半径为Acm,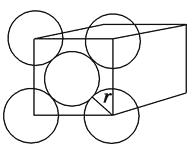
求:
(1)金晶体中最小的一个立方体含有个金原子。
(2)金的密度为g·cm-3。(用带A计算式表示)
(3)金原子空间占有率为。(Au的相对原子质量为197,用带A计算式表示)
【答案】
(1)4
(2)![]()
(3)0.74或74%
【解析】(1)根据晶胞结构可知,金晶体中最小的一个立方体含有(8×1/8+6×1/2)=4个金原子。(2)金原子半径为Acm,则晶胞中面对角线是4Acm,所以晶胞的边长是2 ![]() Acm,所以
Acm,所以 ![]() ×NA=4,解得ρ=
×NA=4,解得ρ= ![]() 。(3)晶胞的体积是(2A)3 , 而金原子占有的体积是4×
。(3)晶胞的体积是(2A)3 , 而金原子占有的体积是4× ![]() πA3 , 所以金原子空间占有率为4×
πA3 , 所以金原子空间占有率为4× ![]() πA3/(2
πA3/(2 ![]() A)3=
A)3= ![]() =74%(0.74)。
=74%(0.74)。

 阅读快车系列答案
阅读快车系列答案【题目】烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
(1)烟气脱硫、脱硝的环境意义是;
(2)一种选择性催化脱硝(NO2)的原理为:6NO2+8NH3 ![]() 7N2+12H2O
7N2+12H2O
① 上述反应中被还原的元素是(填元素符号),反应中每转移3mol电子,生成标准状况下N2的体积为;
② 超音速飞机排放的尾气是平流层中NOx的主要来源.它们破坏臭氧层的主要机理为:
Ⅰ 、O3 ![]() O+O2 Ⅱ 、NO+O3→NO2+O2Ⅲ 、 NO2+O→ NO+O2
O+O2 Ⅱ 、NO+O3→NO2+O2Ⅲ 、 NO2+O→ NO+O2
上述反应中NOx所起的作用是;
(3)下表列出了2种燃煤烟气脱硫方法的原理。
方法Ⅰ | 用氨水将SO2转化为NH4HSO3 , 再氧化成(NH4)2SO4 |
方法Ⅱ | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫 |
①方法Ⅰ中用氨水吸收燃煤烟气中的SO2转化为NH4HSO3 , 是利用了SO2的性质(选填字母编号)。
A.漂白性 B.氧化性 C.还原性 D.酸性氧化物
②方法Ⅰ中氨水吸收燃煤烟气中SO2的化学反应为:2NH3+SO2+H2O=(NH4)2SO3
(NH4)2SO3+SO2+H2O=2NH4HSO3 , 能提高燃煤烟气中SO2去除率的措施有(填字母). A.增大氨水浓度 B.升高反应温度C.使燃煤烟气与氨水充分接触 D.通入空气使HSO3-转化为SO42-
③采用方法Ⅰ脱硫,并不需要预先除去燃煤烟气中大量的CO2 , 原因是(用离子方程式表示)。
【题目】以铝灰(主要成分为Al、Al2O3 , 另有少量CuO、SiO2、FeO和Fe2O3杂质)为原料,可制得液体聚合氯化铝[Alm(OH)nCl3m﹣n],生产的部分过程如图所示(部分产物和操作已略去). 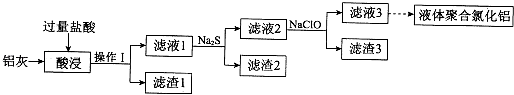
已知某些硫化物的性质如下表:
物质 | 性质 |
Fe2S3 Al2S3 | 在水溶液中不存在 |
FeS | 黑色,难溶于水,可溶于盐酸 |
CuS | 黑色,难溶于水,难溶于盐酸 |
(1)操作I是 . Al2O3与盐酸反应的离子方程式是 .
(2)滤渣2为黑色,该黑色物质的化学式是 .
(3)向滤液2中加入NaClO溶液至不再产生红褐色沉淀,此时溶液的pH约为3.7.NaClO的作用是 .
(4)将滤液3的pH调至4.2~4.5,利用水解反应得到液体聚合氯化铝.反应的化学方程式是 .
(5)将滤液3电解也可以得到液体聚合氯化铝.装置如图所示(阴离子交换膜只允许阴离子通过,电极为惰性电极). 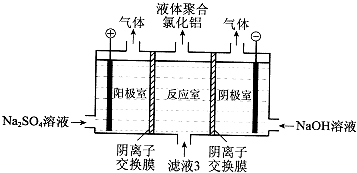
①写出阴极室的电极反应: .
②简述在反应室中生成聚合氯他铝的原理: .