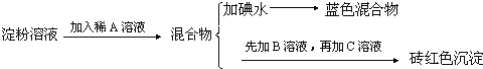
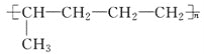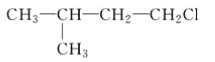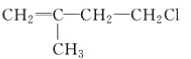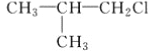题目内容
【题目】实验室中可用如图制备乙炔,回答下列问题
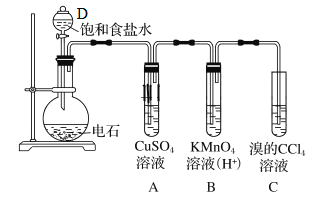
(1)仪器D名称_______________________。
(2)制取乙炔的化学方程式_______________________________________________。
(3)试管A观察到的现象_______________________。
(4)写出C发生的化学方程式______________________________________________。
(5)若没有A装置,观察到B褪色,且有浅黄色浑浊,请写出生成浅黄色浑浊的离子方程式______________。
【答案】分液漏斗 CaC2+2H2O→Ca(OH)2+C2H2↑ 有黑色沉淀出现 CH≡CH+2Br2→CHBr2CHBr2 2MnO4-+5H2S+6H+=5S↓+2Mn2++8H2O
【解析】
电石和饱和食盐水反应生成乙炔,利用硫酸铜溶液除去杂质,利用酸性高锰酸钾溶液和溴的四氯化碳溶液验证乙炔的性质,据此解答。
(1)根据仪器构造可知仪器D的名称为分液漏斗。
(2)制取乙炔的化学方程式为CaC2+2H2O→Ca(OH)2+C2H2↑。
(3)生成的乙炔中含有硫化氢,硫化氢和硫酸铜溶液反应生成硫化铜沉淀,则试管A观察到的现象为有黑色沉淀出现。
(4)乙炔和溴发生加成反应,则发生反应的化学方程式为CH≡CH+2Br2→CHBr2CHBr2。
(5)若没有A装置,观察到B褪色,且有浅黄色浑浊,这说明产生的沉淀是单质硫,因此生成浅黄色浑浊的离子方程式为2MnO4-+5H2S+6H+=5S↓+2Mn2++8H2O。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目