��Ŀ����
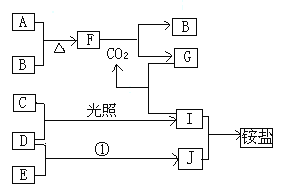
����Ŀ����ͼ�Dz��ֶ�����Ԫ�صĵ��ʼ��仯���������Һ����ת����ϵ����֪B��C��D��E�Ƿǽ��ʣ����ڳ��³�ѹ�¶������壻������G����ɫ��ӦΪ��ɫ��������I��Jͨ��״���³���̬����Ӧ���ǻ��������е�һ����Ҫ�̵���Ӧ
��ش��������⣺
��1���քeд��E��F�ĵ���ʽ��E________��F___________��
��2��ʵ������J�Ļ�ѧ����ʽ____________________________��
��3����F��ȡB�ķ�Ӧ�У�ÿ������״����11.2L��B��ת�Ƶ��ӵ����ʵ���Ϊ__________��
��4����C��D��E.��I��J�����У��Լ��Լ���ϵ���___________________ ������Ӧ����ĸ����ͬ�����ԷǼ��Լ���ϵ���___________��
��5���õ���ʽ��ʾI���γɹ���__________________��
��6���ֽ���״����1.12 L������̼ͨ��60 mL 1 mol/L��A������������Ӧ��ˮ������Һ�У���Ӧ����Һ�����ʵ����ʵ���֮��Ϊ_________________��
���𰸡� ![]()
![]() 2NH4Cl + Ca(OH)2 =��=CaCl2 + 2NH3��+ 2H2O 1mol I��J C��D��E
2NH4Cl + Ca(OH)2 =��=CaCl2 + 2NH3��+ 2H2O 1mol I��J C��D��E ![]() n(Na2CO3) �U n(NaHCO3) = 1�U4
n(Na2CO3) �U n(NaHCO3) = 1�U4
���������ڳ��³�ѹ�£�A�ǹ��壬B��C��D��E�Ƿǽ��������Ҷ������壬������I��Jͨ��״���³���̬��C�ʻ���ɫ��ΪCl2�������嵥��D�ڹ��������·�Ӧ�õ�I����DΪH2��IΪHCl��I��J��Ӧ�õ����H����JΪNH3��HΪNH4Cl��EΪN2������A�����嵥��B��Ӧ�õ�F�ǵ���ɫ�Ļ��������֪AΪNa��BΪO2��F��Na2O2�����������������̼��Ӧ�õ�̼������������������G����ɫ��ӦΪ��ɫ����GΪNa2CO3��
(1)N2��Na2O2�ĵ���ʽ�ֱ���![]() ��
��![]() ��
��
(2)ʵ���������Ȼ�狀���ʯ�һ�ϼ����ư�����������Ӧ�Ļ�ѧ����ʽΪ2NH4Cl + Ca(OH)2 =��=CaCl2 + 2NH3��+ 2H2O��
(3)��Na2O2��ȡO2�ķ�Ӧ�У���Ԫ�صĻ��ϼ۴�-1������Ϊ0�ۣ���ÿ������״����11.2L��O2�����ʵ���Ϊ0.5mol��ת�Ƶ��ӵ����ʵ���Ϊ0.5mol��2=1mol��
(4)Cl2��H2��N2��Ϊ���ʣ�ֻ���ڷǼ��Թ��ۼ�����HCl��NH3�����о����ڼ��Լ����Լ��Լ���ϵ���I��J ���ԷǼ��Լ���ϵ���C��D��E��
(5)HCl�ǹ��ۻ���������ʽ�γɹ���Ϊ![]() ��
��
(6)��״����1.12 L������̼�����ʵ���Ϊ![]() =0.05mol,60 mL 1 mol/L��NaOH��Һ��NaOH�����ʵ���Ϊ1 mol/L��0.06L=0.06mol���跴Ӧ����Һ��Na2CO3�����ʵ���Ϊxmol��NaHCO3�����ʵ���Ϊymol������ԭ���غ�ɵã�x+y=0.05(̼ԭ���غ�)��2x+y=0.06(��ԭ���غ�)����ã�x=0.01��y=0.04����Ӧ����Һ�����ʵ����ʵ���֮��Ϊ0.01mol��0.04mol=1:4��
=0.05mol,60 mL 1 mol/L��NaOH��Һ��NaOH�����ʵ���Ϊ1 mol/L��0.06L=0.06mol���跴Ӧ����Һ��Na2CO3�����ʵ���Ϊxmol��NaHCO3�����ʵ���Ϊymol������ԭ���غ�ɵã�x+y=0.05(̼ԭ���غ�)��2x+y=0.06(��ԭ���غ�)����ã�x=0.01��y=0.04����Ӧ����Һ�����ʵ����ʵ���֮��Ϊ0.01mol��0.04mol=1:4��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�