题目内容
【题目】化学在解决雾霾污染中有着重要的作用,雾霾由多种污染物形成,其中包含颗粒物PM2.5)、
氮氧化物(NOx)、CO、SO2等.
(1)已知:NO(g)+![]() O2(g)═NO2(g)△H=﹣56.5kJmol﹣1
O2(g)═NO2(g)△H=﹣56.5kJmol﹣1
2SO2(g)+O2(g)═2SO3(g)△H=﹣196.6kJmol﹣1
则反应NO2(g)+SO2(g)═SO3(g)+NO(g)△H=_________kJmol﹣1.
一定条件下,将NO2与SO2以物质的量比1:2置于恒温恒容的密闭容器中发生上述反应,
下列能说明反应达到平衡状态的有____________
a.混合气体的平均相对分子质量
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1mol SO3的同时生成1mol NO2
测得上述反应平衡时NO2与SO2物质的量比为1:3,则平衡常数K=________(用分数表示)
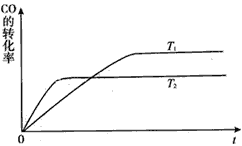
NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。在氨气足量的情况下,不同c(NO2)/c(NO),不同温度对脱氮率的影响如图所示(已知氨气催化还原氮氧化物的正反应为放热反应),请解释300℃之后脱氮率逐渐减小的原因:__________________________

(2)CO综合利用.
①CO用于合成甲醇反应方程式为:CO(g)+2H2(g)═CH3OH(g)
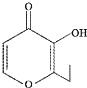
若起始投入1molCO,2mol H2,CO在不同温度下的平衡转化率与压强的关系如图所示.得知该反应的△H_________0,该反应的实际生产条件控制在 250 ℃、1.3×104kPa左右最为适宜.反应达平衡后,下列操作既能加快反应速率,又能使平衡混合物中CH3OH物质的量分数增大的是____________
a. 升温 b.恒容条件下充入H2
c.加入合适的正催化剂 d.恒容条件下再充入1molCO,2mol H2
e.压缩体积 f.移走一部分CH3OH
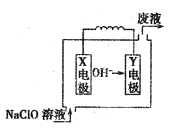
②电解CO制备CH4,电解质为碳酸钠溶液,工作原理如图2所示,写出阴极区电极
反应式_______________

(3)利用喷雾干燥法脱硫工艺是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收,具体步骤如下:
SO2(g)+H2O(l) ![]() H2SO3(l)
H2SO3(l) ![]() H+(aq)+HSO
H+(aq)+HSO![]() (aq) Ⅰ
(aq) Ⅰ
HSO![]() (aq)
(aq) ![]() H+(aq)+SO
H+(aq)+SO![]() (aq) Ⅱ
(aq) Ⅱ
Ca(OH)2(s) ![]() Ca2+(aq)+2OH-(aq) Ⅲ
Ca2+(aq)+2OH-(aq) Ⅲ
Ca2+(aq)+SO![]() (aq)
(aq) ![]() CaSO3(s) Ⅳ
CaSO3(s) Ⅳ
该温度下,测定吸收后液体中c(Ca2+)一直保持为0.70 mol/L,已知Ksp(CaSO3)=1.4×10-7,则吸收后溶液中的SO![]() 的浓度为_________________
的浓度为_________________
【答案】﹣41.8b![]() 300℃时反应达平衡,后升温平衡逆向移动,脱氮率减小<d eCO+6e﹣+5H2O=6OH﹣+CH42×10-7 mol/L
300℃时反应达平衡,后升温平衡逆向移动,脱氮率减小<d eCO+6e﹣+5H2O=6OH﹣+CH42×10-7 mol/L
【解析】(1)①NO(g)+![]() O2(g)═NO2(g)△H=-56.5kJmol-1;②2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJmol-1;将方程式(②-①×2)×
O2(g)═NO2(g)△H=-56.5kJmol-1;②2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJmol-1;将方程式(②-①×2)×![]() 得:NO2(g)+SO2(g)SO3(g)+NO(g)△H=-41.8kJ/mol;
得:NO2(g)+SO2(g)SO3(g)+NO(g)△H=-41.8kJ/mol;
a.随反应:NO2(g)+SO2(g)![]() SO3(g)+NO(g)的进行,气体的质量和物质的量都不变,混合气体的平均相对分子质量始终不变,不能说明到达平衡状态,故a错误;b.混合气体颜色保持不变,说明二氧化氮的浓度不变,说明到达平衡状态,故b正确;c.随反应进行,SO3和NO都是生成物,所以体积比一直等于系数比,所以SO3和NO的体积比保持不变,不能说明到达平衡状态,故c错误;d.每生成1molSO3的同时消耗1molNO2都表示逆反应速率,反应自始至终都按此比例进行,故d错误;答案为b;一定条件下,将NO2与SO2以体积比1:2设为a和2a,消耗二氧化氮为x,
SO3(g)+NO(g)的进行,气体的质量和物质的量都不变,混合气体的平均相对分子质量始终不变,不能说明到达平衡状态,故a错误;b.混合气体颜色保持不变,说明二氧化氮的浓度不变,说明到达平衡状态,故b正确;c.随反应进行,SO3和NO都是生成物,所以体积比一直等于系数比,所以SO3和NO的体积比保持不变,不能说明到达平衡状态,故c错误;d.每生成1molSO3的同时消耗1molNO2都表示逆反应速率,反应自始至终都按此比例进行,故d错误;答案为b;一定条件下,将NO2与SO2以体积比1:2设为a和2a,消耗二氧化氮为x,
NO2(g)+SO2(g)SO3(g)+NO(g)
起始物质的体积 a 2a 0 0
转化物质的体积 x x xx
平衡物质的体积 a-x 2a-xx x
平衡时NO2与SO2体积比为1:3,即(a-x):(2a-x)=1:3,
故x=0.5a,故平衡常数K=![]() ;
;
此反应正方向是放热反应, 300℃时反应达平衡,后升温平衡逆向移动,脱氮率减小;
(2)①图象分析可知压强一定,温度升高CO转化率减小,说明升温平衡逆向进行,逆向是吸热反应,正向为放热反应,△H<0,图象分析可知,温度在250°一氧化碳转化率高,反应速率大,既能加快反应速率,又能使平衡混合物中CH3OH物质的量分数增大,依据影响化学反应速率的因素分析,反应正向进行,CO(g)+2H2(g)═CH3OH(g),反应是气体体积减小的放热反应;a.反应是放热反应,升温反应速率增大,但平衡逆向进行,故a错误;b.恒容条件下充入H2 ,增大反应物浓度平衡正向进行,反应速率增大,CH3OH物质的量分数减小,故b错误;c.催化剂改变反应速率不改变化学平衡,反应速率增大,但平衡不变,故c错误;d.恒容条件下再充入1molCO,2molH2 ,相当于增大压强平衡正向进行,CH3OH物质的量分数增大,故d正确;e.压缩体积压强增大反应速率增大平衡正向进行,CH3OH物质的量分数增大,故e正确;f.移走一部分CH3OH平衡正向进行,浓度减小反应速率减小,故f错误,故de正确;
②由此电解原理可知,阳极失去电子生成二氧化碳气体,加入碳酸钠,碳酸钠与二氧化碳反应生成碳酸氢钠,阴极CO得到电子生成甲烷气体,据此离子反应方程式为:4CO+3CO32-+5H2O=6HCO3-+CH4↑,阴极区电极反应式为:CO+6e-+5H2O=6OH-+CH4;
(3)根据硫酸钙的溶度积常数表达式Ksp(CaSO3)=c(Ca2+)c(SO32-)可知,c(SO32-)=![]() mol/L=2.0×10-7mol/L。
mol/L=2.0×10-7mol/L。