题目内容
室温时,甲、乙两同学在实验室配制氯化钠溶液.甲同学配制5%的NaC1溶液100g,乙同学配制0.5mo1/L的 NaC1溶液100m1(20℃时,氯化钠的溶液的溶解度为36g).下列说法正确的是
- A.两同学所需溶质的质量相同
- B.两同学所需实验仪器种类相同
- C.两同学所配溶液均为不饱和溶液
- D.两同学所配溶液的质量相同
C
分析:A、根据m(溶质)=m(溶液)ω计算配制100g5%的NaC1溶液需要氯化钠质量,根据m=cVM计算配制100m10.5mo1/L的 NaC1溶液需要氯化钠质量;
B、根据溶液配制的实验步骤判断溶液配制需要的仪器;
C、20℃时,氯化钠的溶液的溶解度为36g,饱和溶液的质量分数为 ×100%=26.5%,氯化钠溶液的密度大于1g/mL,根据ω=
×100%=26.5%,氯化钠溶液的密度大于1g/mL,根据ω=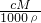 估算0.5mo1/L的 NaC1的质量分数,进行判断;
估算0.5mo1/L的 NaC1的质量分数,进行判断;
D、氯化钠溶液的密度大于1g/mL,100mL氯化钠溶液的质量大于100g.
解答:A、配制100g5%的NaC1溶液需要氯化钠质量为100g×5%=5g,配制100m10.5mo1/L的 NaC1溶液需要氯化钠质量为0.1L×0.5mol/L×58.5g/mol=2.9g,二者需要氯化钠的质量不相等,故A错误;
B、配制一定质量分数的氯化钠溶液,需要用天平称量氯化钠的质量,用药匙去药品,用量筒量取水的体积,在烧杯内溶解,用玻璃棒搅拌,所需仪器有托盘天平、量筒、烧杯、玻璃棒、药匙等;配制一定体积一定物质的量浓度的氯化钠溶液,需要用天平称量氯化钠的质量,用药匙去药品,在烧杯内溶解,用玻璃棒搅拌,洗涤后移入100mL容量瓶,加水定容,距离刻度线1~2cm改用胶头滴管滴加,配制需要的仪器有托盘天平、烧杯、玻璃棒、药匙、100mL容量瓶、胶头滴管等,两种配制需要的仪器不同,故B错误;
C、20℃时,氯化钠的溶液的溶解度为36g,饱和溶液的质量分数为 ×100%=26.5%,氯化钠溶液的密度大于1g/mL,100m10.5mo1/L的 NaC1溶液质量分数ω=
×100%=26.5%,氯化钠溶液的密度大于1g/mL,100m10.5mo1/L的 NaC1溶液质量分数ω=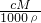 =
=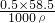 <2.93%,故都是不饱和溶液,故C正确;
<2.93%,故都是不饱和溶液,故C正确;
D、氯化钠溶液的密度大于1g/mL,100mL氯化钠溶液的质量大于100g,故D错误.
故选C.
点评:本题考查一定质量分数溶液与一定体积一定物质的量浓度溶液的配制、物质的量浓度与质量分数的计算与相互关系等,难度中等,注意物质的量浓度与质量分数的定义理解.
分析:A、根据m(溶质)=m(溶液)ω计算配制100g5%的NaC1溶液需要氯化钠质量,根据m=cVM计算配制100m10.5mo1/L的 NaC1溶液需要氯化钠质量;
B、根据溶液配制的实验步骤判断溶液配制需要的仪器;
C、20℃时,氯化钠的溶液的溶解度为36g,饱和溶液的质量分数为
 ×100%=26.5%,氯化钠溶液的密度大于1g/mL,根据ω=
×100%=26.5%,氯化钠溶液的密度大于1g/mL,根据ω=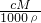 估算0.5mo1/L的 NaC1的质量分数,进行判断;
估算0.5mo1/L的 NaC1的质量分数,进行判断;D、氯化钠溶液的密度大于1g/mL,100mL氯化钠溶液的质量大于100g.
解答:A、配制100g5%的NaC1溶液需要氯化钠质量为100g×5%=5g,配制100m10.5mo1/L的 NaC1溶液需要氯化钠质量为0.1L×0.5mol/L×58.5g/mol=2.9g,二者需要氯化钠的质量不相等,故A错误;
B、配制一定质量分数的氯化钠溶液,需要用天平称量氯化钠的质量,用药匙去药品,用量筒量取水的体积,在烧杯内溶解,用玻璃棒搅拌,所需仪器有托盘天平、量筒、烧杯、玻璃棒、药匙等;配制一定体积一定物质的量浓度的氯化钠溶液,需要用天平称量氯化钠的质量,用药匙去药品,在烧杯内溶解,用玻璃棒搅拌,洗涤后移入100mL容量瓶,加水定容,距离刻度线1~2cm改用胶头滴管滴加,配制需要的仪器有托盘天平、烧杯、玻璃棒、药匙、100mL容量瓶、胶头滴管等,两种配制需要的仪器不同,故B错误;
C、20℃时,氯化钠的溶液的溶解度为36g,饱和溶液的质量分数为
 ×100%=26.5%,氯化钠溶液的密度大于1g/mL,100m10.5mo1/L的 NaC1溶液质量分数ω=
×100%=26.5%,氯化钠溶液的密度大于1g/mL,100m10.5mo1/L的 NaC1溶液质量分数ω=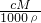 =
=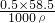 <2.93%,故都是不饱和溶液,故C正确;
<2.93%,故都是不饱和溶液,故C正确;D、氯化钠溶液的密度大于1g/mL,100mL氯化钠溶液的质量大于100g,故D错误.
故选C.
点评:本题考查一定质量分数溶液与一定体积一定物质的量浓度溶液的配制、物质的量浓度与质量分数的计算与相互关系等,难度中等,注意物质的量浓度与质量分数的定义理解.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目