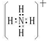
题目内容
干洗衣服的干洗剂的主要成分是四氯乙烯(CCl2=CCl2),下列有关叙述不正确的是( )
| A、它属于烯烃 | B、它能使Br2的CCl4溶液褪色 | C、它能使酸性高锰酸钾溶液褪色 | D、它能发生加聚反应 |
分析:四氯乙烯(CCl2=CCl2)中,含-Cl和碳碳双键,结合烯烃及卤代烃的性质解答.
解答:解:A.烯烃中只有C、H元素,该物质含Cl元素,不属于烯烃,故A错误;
B.含碳碳双键,则能使Br2的CCl4溶液褪色,故B正确;
C.含碳碳双键,则能使酸性高锰酸钾溶液褪色,故C正确;
D.含碳碳双键,则能发生加聚反应,故D正确;
故选A.
B.含碳碳双键,则能使Br2的CCl4溶液褪色,故B正确;
C.含碳碳双键,则能使酸性高锰酸钾溶液褪色,故C正确;
D.含碳碳双键,则能发生加聚反应,故D正确;
故选A.
点评:本题考查有机物的结构与性质,为高考常见题型,把握有机物中的官能团为解答本题的关键,熟悉烯烃的性质即可解答,题目难度不大.

练习册系列答案
相关题目
纳米材料二氧化钛(TiO2)可做优良的催化剂.
Ⅰ.工业上二氧化钛的制备方法:
①将干燥后的金红石(主要成分为TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4.
②将SiCl4分离,得到纯净的TiCl4.
③在TiCl4中加水、加热,水解得到沉淀TiO2?xH2O.
④TiO2?xH2O高温分解得到TiO2.
(1)根据资料卡片中信息判断,TiCl4与SiCl4在常温下的状态是 ,分离二者所采取的操作名称是 .
(2)③中反应的化学方程式是 .
(3)若④在实验室完成,应将TiO2?xH2O放在 (填仪器名称)中加热(图1).
Ⅱ.据报道:能“吃废气”的“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2,其过程大致如下:
a.O2-→2O b.O+H2O-→2OH c.OH+OH-→H2O2
(4)b中破坏的是 (填“极性共价键”或“非极性共价键”).
(5)H2O2能清除路面空气中的CxHy、CO等,主要是利用了H2O2的 (填“氧化性”或“还原性”).
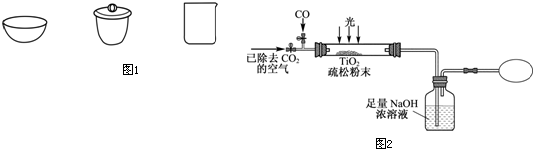
Ⅲ.某研究性学习小组用下列装置模拟“生态马路”清除CO的原理(图2).(夹持装置已略去)
(6)若缓慢通入22.4L(已折算成标准状况)CO气体,结果NaOH溶液增重16.5g,则CO的转化率为 .
(7)当CO气体全部通入后,还要通一会儿空气,其目的是 .
| 资料卡片 | ||
| 物质 | 熔点/℃ | 沸点/℃ |
| SiCl4 | -70 | 57.6 |
| TiCl4 | -25 | 136.5 |

Ⅰ.工业上二氧化钛的制备方法:
①将干燥后的金红石(主要成分为TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4.
②将SiCl4分离,得到纯净的TiCl4.
③在TiCl4中加水、加热,水解得到沉淀TiO2?xH2O.
④TiO2?xH2O高温分解得到TiO2.
(1)根据资料卡片中信息判断,TiCl4与SiCl4在常温下的状态是
(2)③中反应的化学方程式是
(3)若④在实验室完成,应将TiO2?xH2O放在
Ⅱ.据报道:能“吃废气”的“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2,其过程大致如下:
a.O2-→2O b.O+H2O-→2OH c.OH+OH-→H2O2
(4)b中破坏的是
(5)H2O2能清除路面空气中的CxHy、CO等,主要是利用了H2O2的
Ⅲ.某研究性学习小组用下列装置模拟“生态马路”清除CO的原理(图2).(夹持装置已略去)
(6)若缓慢通入22.4L(已折算成标准状况)CO气体,结果NaOH溶液增重16.5g,则CO的转化率为
(7)当CO气体全部通入后,还要通一会儿空气,其目的是
 A、【供选学《化学与生活》考生作答】
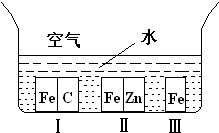
A、【供选学《化学与生活》考生作答】(1)如右图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是
(2)氟氯代烷是一种破坏臭氧层的物质.在大气平流层中,氟氯代烷受紫外线的照射分解出氯原子,氯原子参与下列有关反应:
①Cl+O3→ClO+O2;②O3→O+O2;③ClO→Cl+O2
上列反应的总反应式是
(3)碳酸氢钠是常见的疏松剂,主要是因为它在加热条件下产生了气体,使食品变得疏松.试写出碳酸氢钠受热分解的化学方程式
(4)垃圾资源化的方法是
A、填埋 B、焚烧 C、堆肥法 D、分类回收法
B【供选学《化学反应原理》考生作答】
设反应①Fe(s)+CO2(g)═FeO(s)+CO(g)的平衡常数为K1.反应②Fe(s)+H2O(g)═FeO(s)+H2(g)的平衡常数K2,在不同温度下,K1、K2的值如下:
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
(2)现有反应③CO2(g)+H2(g)═CO(g)+H2O(g)写出该反应的平衡常数K3的数学表达式:K3═
(3)书写热化学方程式:
①1mol N2(g)与适量O2(g)起反应,生成NO2(g),吸收68KJ热量:
②NH3(g)燃烧生成NO2(g)和H2O(g),已知
(1)2H2(g)+O2(g)═2H2O(g)△H═-483.6kJ/mol
(2)N2(g)+2O2(g)═2NO2(g)△H═+67.8kJ/mol
1,N2(g)+3H2(g)═2NH3(g)△H═-92.0kJ/mol
NH3(g)燃烧生成NO2(g)和H2O (g)热化学方程式: