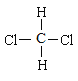
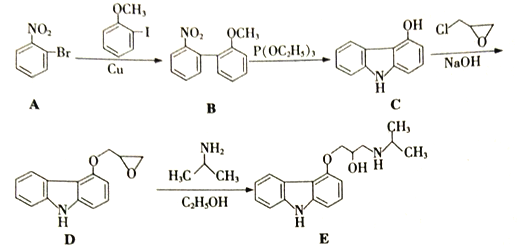
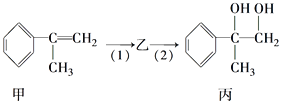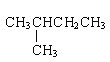题目内容
【题目】在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)![]() 3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时达到平衡并测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算
3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时达到平衡并测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算
(1)5min末A的物质的量浓度为________mol/L。
(2)前5min内用B表示的化学反应速率v(B)为_____mol/(L·min)。
(3)化学方程式中n值为________。
(4)此反应在四种不同情况下的反应速率分别为:
①v(B)=6mol/(L·min) ②v(A)=5mol/(L·min)
③v(C)=4.5mol/(L·min) ④v(D)=8mol/(L·min)
其中反应速率最快的是_____(填编号)。
(5)相同条件下,密闭容器内开始时与平衡时的压强比为_____。
【答案】1.5mol/L 0.2mol/(Lmin) 2 ② 5:6
【解析】
(1)根据C的物质的量计算反应的A的物质的量,再利用浓度公式 计算;
(2)根据C的物质的量计算反应的B的物质的量,根据反应速率公式计算;
(3)根据同一反应中、同一时间段内,各物质的反应速率之比等于计量数之比确定n值;
(4)把不同物质的反应速率换算成同一物质的反应速率进行比较;
(5)恒温恒容的条件下,容器内气体压强与混合气体的总物质的量成正比。
(1) A(g)+2B(g)3C(g)+nD(g),
反应开始 4mol 6mol 0 0
反应 1mol 2mol 3 mol
5min末 3mol 4mol 3 mol
c(A)=![]() =
=![]() =1.5 mol/L;
=1.5 mol/L;
(2)v(B)=![]() =
=![]() =0.2mol/(Lmin);
=0.2mol/(Lmin);
(3)根据同一反应中、同一时间段内,各物质的反应速率之比等于计量数之比;所以v(B):v(D)=0.2mol/(Lmin):0.2mol/(Lmin)=2:n,解得:n=2;
(4)把所有速率都换算成A的反应速率;①由v(B)=6 mol/(Lmin)知,v(A)=3mol/(Lmin);②v(A)=5mol/(Lmin);③由v(C)=4.5mol/(Lmin)知,v(A)=1.5mol/(Lmin);④由v(D)=8mol/(Lmin)知,v(A)=4mol/(Lmin);其中②表示的A的速率最快,故答案为②;
(5)由n=2可知5min末达到平衡时D的物质的量为3mol×![]() =2mol,平衡时混合气体的总物质的量为12mol,则相同条件下,密闭容器内开始时与平衡时的压强比为10mol:12mol=5:6。
=2mol,平衡时混合气体的总物质的量为12mol,则相同条件下,密闭容器内开始时与平衡时的压强比为10mol:12mol=5:6。