题目内容
(1)金属腐蚀一般可分为化学腐蚀和 腐蚀。
(2)炒过菜的铁锅未及时洗净容易发生腐蚀。
①若铁锅内残液呈弱酸性,则腐蚀属于 (填“吸氧”或“析氢”,下同)腐蚀;若残液中主要含有NaCl,腐蚀应属于 腐蚀。
②吸氧腐蚀中,负极的电极反应式为 。
铁锈中铁的化合价为 。
(1)电化学(1分)
(2)①析氢 (1分);吸氧 (1分)
② Fe- 2e-=Fe2+ (2分) +3 (1分)
【解析】
试题解析:(1)金属腐蚀一般分为化学腐蚀和电化学腐蚀。
(2)①在酸性条件下会发生析氢腐蚀,在中性或碱性条件下会发生吸氧腐蚀,
②吸氧腐蚀中,负极发生氧化反应,铁失去电子而成为Fe2+,与正极产生的OH-结合生成Fe(OH)2,在空气中继续被氧化最终生成Fe2O3,所以铁锈中铁的化合价为+3价。
考点:考查金属的电化学腐蚀、析氢、吸氧腐蚀的区别以及电极反应方程式的书写

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
阳离子 | Ag+ Na+ |
阴离子 | NO3- SO42- Cl- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、 B、 C三种溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了27g。常温下各烧杯中溶液的pH与电解时间(t)的关系如图。据此回答下列问题:
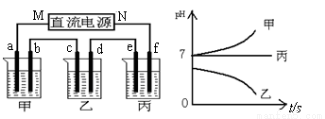
(1)M为电源的 极(填“正”或“负”),甲电解质为 (填化学式)。
(2)写出丙烧杯中反应的化学方程式 。
(3)有人设想用图一所示原电池为直流电源完成上述电解。则锌电极相当于直流电源的 (填“M”或“N”)极。
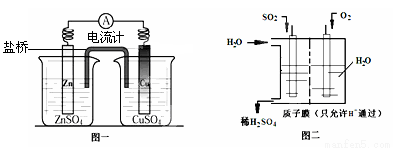
(4)有人设想用图二所示装置做直流电源,不仅可以完成电解也能将气体SO2转化
为重要化工原料。该设想中负极的电极反应式为 。




