题目内容
(12分)中学常见反应的化学方程式是A+B→X+Y+H2O(未配平,反应条件略去),其中A、B的物质的量之比为1:4。请回答:
(1)若Y是黄绿色气体,则Y的电子式是 _______ ,该反应的化学方程式是__________________________________ 。
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是____________________。
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中。
①A元素在周期表中的位置是_______(填所在周期和族);Y的化学式是_______。
②含a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是_______ mol。
(1)若Y是黄绿色气体,则Y的电子式是 _______ ,该反应的化学方程式是__________________________________ 。
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是____________________。
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中。
①A元素在周期表中的位置是_______(填所在周期和族);Y的化学式是_______。
②含a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是_______ mol。
(共12分)
(1) (2分) MnO2+4HCl(浓)
(2分) MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O(2分)
MnCl2+Cl2↑+2H2O(2分)
(2)4:1(2分)
(3)①第4周期 Ⅷ族(2分) NO(2分) ②0.4a(2分)
(1)
 (2分) MnO2+4HCl(浓)
(2分) MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O(2分)
MnCl2+Cl2↑+2H2O(2分) (2)4:1(2分)
(3)①第4周期 Ⅷ族(2分) NO(2分) ②0.4a(2分)
(1)很明显Y为氯气,与浓盐酸反应的方程式为:
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O(2分)
MnCl2+Cl2↑+2H2O(2分)
(2)A为碳单质;C+4HNO3 4NO2+CO2+2H2O
4NO2+CO2+2H2O
(3)A为金属单质,由“钝化”“两种金属阳离子”可判定A为铁。
设被还原的铁离子的物质量为xmol
2Fe3++Fe=3Fe2+
x 1.5x
1.5x=a-x, x=0.4a
MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O(2分)
MnCl2+Cl2↑+2H2O(2分)(2)A为碳单质;C+4HNO3
 4NO2+CO2+2H2O
4NO2+CO2+2H2O(3)A为金属单质,由“钝化”“两种金属阳离子”可判定A为铁。
设被还原的铁离子的物质量为xmol
2Fe3++Fe=3Fe2+
x 1.5x
1.5x=a-x, x=0.4a

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目



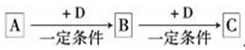


 示)
示) (用元素符号表示),下列表述中能证明这一事实的是 (填序号)。
(用元素符号表示),下列表述中能证明这一事实的是 (填序号)。