题目内容
在上海召开的第七届全球人类基因大会上,我国科学家第一次提出可以用砒霜(As2O3)来治疗早期幼粒白血病。已知砒霜具有两性。(1)完成并配平下列化学方程式:
□As2O3+□Zn+□H2SO4![]() □AsH3+□ZnSO4+□
□AsH3+□ZnSO4+□
(2)As2O3在上述反应中显示出来的性质是________________________。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)若生成0.1 mol AsH3,则转移电子的物质的量为________mol。
(4)砒霜在烧碱溶液中反应的离子方程式为________________________________________。
解析:(1)根据化合价升降法,按照配平步骤先把发生变价的元素配平,而后利用质量守恒定律,观察配平其他元素并确定所缺物质的化学式。
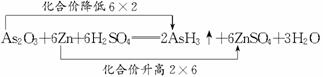
(2)在上述反应中砷元素的化合价降低,故As2O3显氧化性。
(3)由于每生成2 mol AsH3时,转移12 mol电子,故生成0.1 mol AsH3时转移电子的物质的量为0.6 mol。
(4)由于砒霜呈两性,故与烧碱的反应为非氧化还原反应,离子方程式为As2O3+6OH-====
![]() +3H2O
+3H2O
答案:(1)1 6 6 2 6 3H2O (2)A
(3)0.6 (4)As2O3+6OH-====![]() +3H2O
+3H2O

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
在上海召开的第七届全球人类基因大会上,我国科学家第一次提出可以用砒霜(As2O3)来治疗早期幼粒白血病。(本题共7分)
(1)完成并配平下列化学方程式:
As2O3+ Zn+ H2SO4 → AsH3+ ZnSO4+ ______
(2)As2O3在上述反应中显示出来的性质是_____________。
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |