题目内容
已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,下列说法正确的是( )
| X | Y |
| Z | W |
| A、W的原子序数可能是Y的原子序数的2倍 |
| B、Z元素的原子半径可能比Y元素的小 |
| C、W的气态氢化物的稳定性一定比Y的强 |
| D、若Z的最高正价为+m,则X的最高正价也一定为+m |
分析:由X、Y、Z、W四种短周期主族元素在周期表中的相对位置可知,则X、Y在第二周期,Z、W在第三周期,结合常见元素的性质及元素周期律来解答.
解答:解:A.若W为S,Y为O,则W的原子序数可能是Y的原子序数的2倍,故A正确;
B.电子层越多,原子半径越大,则Z的原子半径大于Y的原子半径,故B错误;
C.同主族,原子序数大的非金属性弱,其气态氢化物的稳定性弱,则W的气态氢化物的稳定性比Y的弱,故C错误;
D.若Z的最高正价为+m,且Z为S元素时,X没有正价,故D错误;
故选A.
B.电子层越多,原子半径越大,则Z的原子半径大于Y的原子半径,故B错误;
C.同主族,原子序数大的非金属性弱,其气态氢化物的稳定性弱,则W的气态氢化物的稳定性比Y的弱,故C错误;
D.若Z的最高正价为+m,且Z为S元素时,X没有正价,故D错误;
故选A.
点评:本题考查位置、结构、性质的关系及应用,把握元素在周期表中的位置及元素周期律为解答的关键,注意利用实例分析,侧重分析能力和归纳能力的考查,题目难度不大.

练习册系列答案
相关题目








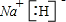
 已知X、Y、Z、W四种短周期元素的原子半径依次减小.在周期表中X与Y、Y与Z均位同一周期的相邻位置;X的最外层电子数为次外层电子数的2倍;W分别能与X、Y、Z按一定原子数比形成电子总数为10的常见化合物.请判断X、Y、Z、W四种元素并回答下列问题:(要求用确定后的元素符号及有关化学用语表示)
已知X、Y、Z、W四种短周期元素的原子半径依次减小.在周期表中X与Y、Y与Z均位同一周期的相邻位置;X的最外层电子数为次外层电子数的2倍;W分别能与X、Y、Z按一定原子数比形成电子总数为10的常见化合物.请判断X、Y、Z、W四种元素并回答下列问题:(要求用确定后的元素符号及有关化学用语表示)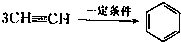 三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有量个氨基.请写出三聚氰胺结构简式:
三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有量个氨基.请写出三聚氰胺结构简式: