题目内容
氢气是人类最理想的能源。已知在25℃、101 kPa下,1 g 氢气完全燃烧生成液态水时放出热量142.9 kJ,则下列热化学方程式书写正确的是( )
| A.2H2+O2=2H2OΔH=-142.9 kJ·mol-1 |
| B.2H2(g)+O2(g)=2H2O(l)ΔH=-142.9 kJ·mol-1 |
| C.2H2(g)+O2(g)=2H2O(l)ΔH=-571.6 kJ·mol-1 |
| D.2H2(g)+O2(g)=2H2O(l)ΔH=+571.6 kJ·mol-1 |
C
解析

练习册系列答案
 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
已知25℃、101kPa条件下:
4Al (s) + 3O2 (g)=2Al2O3 (s) △H=-2834.9 kJ/mol
4Al (s) + 2O3 (g) = 2Al2O3 (s) △H= -3119.91kJ/mol
由此得出的结论正确的是
| A.等质量的O2比O3能量低,由O2变O3为放热反应 |
| B.等质量的O2比O3能量低,由O2变O3 为吸热反应 |
| C.3O2(g)=2O3 (g)△H=285.0 kJ/mol |
| D.O3比O2稳定,由O2变O3 为吸热反应 |
下列有关中和热的说法正确的是( )
| A.表示中和热的热化学方程式:H+(l)+OH-(l)=H2O(l) ΔH=-57.3 kJ/mol |
| B.准确测量中和热的实验过程中,至少需测定温度4次 |
| C.中和热的实验过程中,环形玻璃搅拌棒材料若用铜代替,则测量出的中和热数值偏小 |
| D.已知2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ/mol,则该反应的中和热为114.6 kJ/mol |
已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+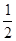 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是
| A.CH3OH转变成H2的过程一定要吸收能量 |
| B.①反应中,反应物的总能量高于生成物总能量 |
C.根据②推知反应:CH3OH(l)+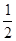 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 |
| D.反应②中的能量变化如下图所示 |
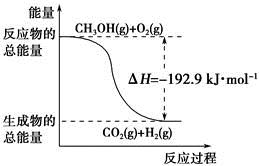
下列说法正确的是( )
| A.需要加热方能发生的反应一定是吸热反应 |
| B.若反应为放热反应,则该反应不必加热就可发生 |
| C.放热反应比吸热反应容易发生 |
| D.化学反应都伴随着能量的变化 |
我国二氧化碳的排放量位居世界第二,为减少二氧化碳这种温室气体的排放,下列措施不对的是( )
| A.大力发展氢能源 | B.充分利用太阳能 |
| C.使用含碳能源 | D.提高能源利用率 |
常温下,已知:
4Al(s)+3O2(g)=2Al2O3(s)ΔH1
4Fe(s)+3O2(g)=2Fe2O3(s)ΔH2
下面关于ΔH1、ΔH2的比较正确的是( )
| A.ΔH1>ΔH2 | B.ΔH1<ΔH2 |
| C.ΔH1=ΔH2 | D.无法计算 |
氯原子对O3分解有催化作用:O3+Cl=ClO+O2 ΔH1,ClO+O=Cl+O2 ΔH2,大气臭氧层的分解反应是:O3+O=2O2 ΔH,该反应的能量变化示意图如图所示,下列叙述中,正确的是( )
| A.反应O3+O=2O2的ΔH=E1-E3 |
| B.反应O3+O=2O2的ΔH=E2-E3 |
| C.O3+O=2O2是吸热反应 |
| D.ΔH=ΔH1+ΔH2 |
甲烷是一种高效清洁的新能源,0.25 mol CH4完全燃烧生成液态水时放出222.5 kJ热量,则下列热化学方程式中正确的是( )
A.2CH4(g)+4O2(g) 2CO2(g)+4H2O(l) ΔH="+890" kJ·mol-1 2CO2(g)+4H2O(l) ΔH="+890" kJ·mol-1 |
B.CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH="+890" kJ·mol-1 CO2(g)+2H2O(l) ΔH="+890" kJ·mol-1 |
C.CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH="-890" kJ·mol-1 CO2(g)+2H2O(l) ΔH="-890" kJ·mol-1 |
D.2CH4(g)+4O2(g) 2CO2(g)+4H2O(l) ΔH="-890" kJ·mol-1 2CO2(g)+4H2O(l) ΔH="-890" kJ·mol-1 |