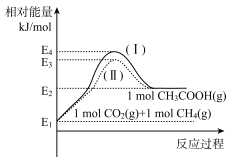
题目内容
【题目】下列说法不正确的是( )
A.实验室用Ca(OH)2固体和NH4Cl固体共热制NH3
B.常温下铁遇浓硝酸钝化,常温下可用铁罐储存浓硝酸
C.向蔗糖中滴入浓硫酸后变黑,体现了浓硫酸的脱水性
D.FeCl2溶液中滴入KSCN溶液,溶液变红
【答案】D
【解析】解:A.氯化铵与氢氧化钙在加热条件下反应生成氨气,实验室用此反应制备氨气,故A正确;B.浓硝酸具有强的氧化性,常温下能够使铁钝化,生成致密氧化膜,阻止反应进行,所以常温下可用铁罐储存浓硝酸,故B正确;
C.浓硫酸具有脱水性,能够使蔗糖脱水而碳化变黑,故C正确;
D.三价铁离子与到硫氰根离子显血红色,二价铁离子遇到KSCN溶液无明显现象,故D错误;
故选:D.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
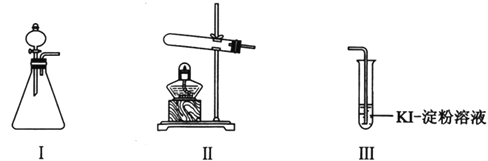
供选试剂:30% H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体
(1)小组同学设计甲、乙、丙三组实验,记录如下:
操作 | 现象 | |
甲 | 向I的锥形瓶中加入______,.向I的______中加入30% H2O2溶液,连接I、Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式是__________________________。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是___________。为进一步探究该条件对反应速率的影响,可采取的实验措施是________。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列________溶液(填序号),证明了白雾中含有H2O2。
A.酸性 KMnO4 B. FeCl2 C. Na2S D.品红
(5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI +O2 +2H2O=2I2 + 4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应(写离子方程式)________________________造成的,请设计实验证明他们的猜想是否正确________________________________________________。