题目内容
某酸性溶液可能含有Br-、SO42-、H2SO3、NH4+等,分别对该溶液进行如下实验:
①加热时放出的气体可使品红溶液褪色;
②加入碱溶液使溶液呈碱性,再加热时放出的气体可使湿润的红色石蕊试纸变蓝;
③加入氯水时,溶液略呈橙红色,再加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀。
对于下列物质不能确定其在原溶液中是否存在的是( )
| A.Br- | B.SO42- | C.H2SO3 | D.NH4+ |
B
解析

练习册系列答案
 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
| | 操作 | 现象 | 结论 |
| A | 先滴加BaCl2溶液,再加稀HNO3 | 生成白色沉淀, 且沉淀不溶解。 | 原溶液中有SO42- |
| B | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫红色 | 原溶液中有I― |
| C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
| D | 滴加NaOH溶液加热,将红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
物质制备过程中离不开物质的提纯。以下除杂方法不正确的是( )
| 选项 | 目 的 | 实验方法 |
| A | 除去Na2CO3固体中的NaHCO3 | 置于坩埚中加热至恒重 |
| B | 除去NaCl中少量KNO3 | 将混合物制成热饱和溶液,冷却结晶,过滤 |
| C | 除去CO2中的HCl气体 | 通过NaHCO3(aq,饱和),然后干燥 |
| D | 除去C2H5Br中的Br2 | 加入足量Na2SO3(aq),充分振荡,分液 |
某澄清溶液可能含有K+、Al3+、Mg2+、NH4+、Fe2+、SO42-、CO32-中的一种或几种,为确定其成分,进行如下实验:①取部分溶液,逐滴滴入用HCl酸化的BaCl2溶液,只产生白色沉淀;②另取部分溶液,缓慢加入足量的Na2O2固体并加热,产生无色无味的气体,同时产生白色沉淀后白色沉淀部分溶解。下列推断正确的是
| A.肯定有Al3+、SO42-,可能有K+、NH4+ |
| B.肯定无NH4+、Mg2+、CO32-,可能有Fe2+ |
| C.原溶液一定是明矾和MgSO4的混合溶液 |
| D.肯定有Mg2+,K+只能通过焰色反应才能确定 |
从海水中提取镁的工业生产流程如下: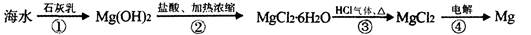
下列说法错误的是
| A.此法的优点之一是原料来源丰富 |
| B.该提取镁的过程中涉及置换、分解、复分解和氧化还原反应 |
| C.步骤①②③的目的是从海水中提取无水MgCl2 |
| D.步骤②中加盐酸的离子方程式为Mg(OH)2+2H+=Mg2++2H2O |
对于实验甲~丁的实验现象预测正确的是( )
| A.实验甲:逐滴滴加盐酸时,试管中立即产生大量气泡 |
| B.实验乙:充分振荡后静置,下层溶液为橙红色,上层无色 |
| C.实验丙:从饱和食盐水中提取NaCl晶体 |
| D.装置丁:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去 |
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )。
| 选项 | 操 作 | 现 象 | 结 论 |
| A | 某气体遇湿润的淀粉碘化钾试纸 | 试纸变蓝 | 该物质一定是氯气 |
| B | 滴加氯水和苯,振荡、静置 | 上层溶液显紫色 | 原溶液中有I- |
| C | 用洁净铂丝蘸取少量溶液进行焰色反应 | 火焰呈黄色 | 原溶液一定是钠盐溶液 |
| D | 滴加BaCl2溶液 | 产生不溶于稀硝酸的白色沉淀 | 原溶液一定含有Ag+ |
有关海洋中部分资源的利用的说法不正确的是( )
| A.工业上利用Cl2与澄清石灰水反应制取漂白粉 |
| B.用MgCl2·6H2O晶体制无水MgCl2,需在HCl气流中加热脱水 |
| C.SO2水溶液吸收Br2的化学方程式为Br2+SO2+2H2O=H2SO4+2HBr |
| D.粗碘中混有少量ICl和IBr可加入KI进行升华提纯 |
下列实验设计能完成或实验结论合理的是 ( )。
| A.证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾淀粉试纸检验,观察试纸颜色的变化 |
| B.铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,该铝热剂不含氧化铁 |
| C.测氯水的pH可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较 |
| D.用新制氢氧化铜悬浊液可以鉴别甲酸、甲酸甲酯、乙酸、乙酸乙酯四种物质 |