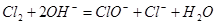题目内容
已知:2BrO3- +Cl2=Br2 +2ClO3-;5Cl2 +I2 +6H2O=2HIO3 +10HCl;ClO3-+5Cl-+6H+=3Cl2+3H2O判断下列物质氧化能力强弱顺序为
| A.BrO3->ClO3->IO3->Cl2 | B.BrO3->Cl2>ClO3->IO3- |
| C.BrO3->ClO3->Cl2>IO3- | D.Cl2>BrO3->ClO3->IO3- |
C
试题分析:在氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,同样还原剂的还原性强于还原产物的还原性。在反应2BrO3- +Cl2=Br2 +2ClO3-中溴元素的化合价降低,氯元素的化合价升高,因此BrO3-是氧化剂,ClO3-是氧化产物,则氧化性是BrO3->ClO3-;在反应5Cl2 +I2 +6H2O=2HIO3+10HCl中氯元素的化合价降低,碘元素的化合价升高,所以氯气是氧化剂,HIO3是氧化产物,则氧化性是Cl2>IO3-;在反应ClO3-+5Cl-+6H+=3Cl2+3H2O中ClO3-氯元素的化合价降低,氯离子中氯元素的化合价升高,因此ClO3-是氧化剂,氯气是氧化产物,则氧化性是ClO3->Cl2,综上所述氧化性是BrO3->ClO3->Cl2>IO3-,答案选C。

练习册系列答案
相关题目
 的氧化性比
的氧化性比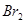 强
强 强
强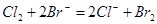
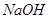 溶液与
溶液与