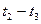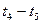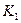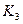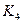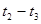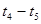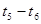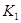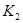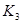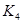题目内容
25°C时,若体积为Va、pH=a的某一元强酸与体积为Vb、pH=b 的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b,请填写下列空白:
(1)a值可否等于3 (填“可”或“否”),其理由是
(2)a值可否等于5 (填“可”或“否”),其理由是
(3)a的取值范围是
(1)否,若a=3,则b=6,碱溶液显酸性,与题意不符
(2)否,若a=5,C(H+)=10—5 mol/L,则b=5,c(OH-)=10—4 mol/L,
Va/Vb= c(OH-)/ c(H+)>1,不合题意
(3)Va/Vb= c(OH-)/ c(H+)=10(a+b-14)<1 ,故(a+b-14)<0,而a=0.5b,即3a<14,a<14/3,pH=b=2a>7,所以3.5<a<14/3。
【解析】考查pH的有关计算。
(1)如果a=3,则根据a=0.5b可知,b=6。由于在常温下碱溶液的pH一定是大于7的,因此假设是不能成立的。
(2)如果a=5,则根据a=0.5b可知,b=10。此时c(H+)=10—5 mol/L,c(OH-)=10—4 mol/L,
Va/Vb= c(OH-)/c(H+)>1,不合题意.因此假设是不能成立的。
(3)根据Va/Vb= c(OH-)/c(H+)可知,Va/Vb= 10(a+b-14)<1 ,故(a+b-14)<0。由于a=0.5b,因此3a<14,a<14/3,pH=b=2a>7,所以3.5<a<14/3。

 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
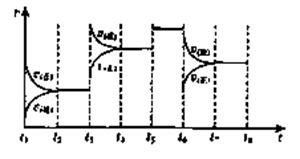
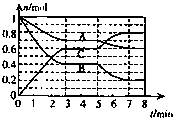
浙江之星课时优化作业系列答案(10分)25°C时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(mol)随时间t的变化如右图所示,已知达平衡后,降低温度,A的转化率将增大。
(1)根据上图数据,写出该反应的化学方程式: ;此反应的平衡常数表达式K= ,从反应开始到达第一次平衡时的平均速率v(A)为 。
(2)在5—7min内,若K值不变,则此处曲线变化的原因是
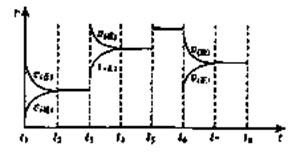
(3)下图表示此反应的反应速率v和时间t的关系图:
各阶段的平衡常数如下表所示:
|
|
|
|
|
|
|
|
|
|
K1、K2、K3、K4之间的关系为: (用“>”、“<”或“=”连接)A的转化率最大的一段时间是
 ol)随时间t的变化如右图所示,已知达平衡后,降低温度,A的转化率将增大。
ol)随时间t的变化如右图所示,已知达平衡后,降低温度,A的转化率将增大。