题目内容
某无色透明的溶液,其中只可能含有大量的K+、Cu2+、OH-、SO32-、Cl-、CO32-、HCO3-、MnO4-、SO42-等离子中的几种,进行如下实验:
①测定溶液的pH,溶液显强碱性 ②若向溶液中加入稀盐酸至溶液呈酸性,产生无色无味且能使澄清石灰水变混浊的气体 ③在②的溶液中再滴加Ba(NO3)2溶液,产生白色沉淀 ④取③中的上层清液继续滴加Ba(NO3)2溶液至不再产生沉淀时,静置,向上层清液中再滴加AgNO3溶液.产生白色沉淀.
完成下列问题:
(1)根据实验,可确定上述离子中一定含有的是 ,无法确定的是 ;不能确定的原因是
(2)实验③中发生反应的离子方程式是 .
①测定溶液的pH,溶液显强碱性 ②若向溶液中加入稀盐酸至溶液呈酸性,产生无色无味且能使澄清石灰水变混浊的气体 ③在②的溶液中再滴加Ba(NO3)2溶液,产生白色沉淀 ④取③中的上层清液继续滴加Ba(NO3)2溶液至不再产生沉淀时,静置,向上层清液中再滴加AgNO3溶液.产生白色沉淀.
完成下列问题:
(1)根据实验,可确定上述离子中一定含有的是
(2)实验③中发生反应的离子方程式是
分析:(1)根据无色溶液,排除有颜色的离子;根据实验①溶液显强碱性肯定存在OH-,排除HCO3-存在,根据实验②的现象肯定存在CO32-,③在②的溶液中再滴加Ba(NO3)2溶液,产生白色沉淀肯定存在SO42-,④取③中的上层清液继续滴加Ba(NO3)2溶液至不再产生沉淀时,静置,向上层清液中再滴加AgNO3溶液.产生白色沉淀不能确定Cl-是否存在,因实验②中加入盐酸引入了Cl-,干扰了原溶液中Cl-的检验;
(2)③在②的溶液中再滴加Ba(NO3)2溶液,硫酸根离子和钡离子反应生成白色沉淀BaSO4.
(2)③在②的溶液中再滴加Ba(NO3)2溶液,硫酸根离子和钡离子反应生成白色沉淀BaSO4.
解答:解:(1)Cu2+在溶液中为蓝绿色、MnO4-在溶液中为紫色,该溶液为无色透明,所以一定不含有Cu2+、MnO4-,由于溶液的电中性,必须有阳离子,所以存在K+;根据实验①溶液显强碱性肯定存在OH-,因HCO3-+OH-=CO32-+H2O,排除HCO3-存在,根据实验②产生无色无味且能使澄清石灰水变混浊的气体,因CO32-+2H+=CO2↑+H2O,CO2+Ca(OH)2═CaCO3↓+H2O,肯定存在CO32-,-,③在②的溶液中再滴加Ba(NO3)2溶液,产生白色沉淀Ba2++SO42-=BaSO4↓肯定存在SO42-,实验②中加入盐酸引入了Cl-,干扰了原溶液中Cl-的检验,所以④取③中的上层清液继续滴加Ba(NO3)2溶液至不再产生沉淀时,静置,向上层清液中再滴加AgNO3溶液.产生白色沉淀为氯化银,不能确定Cl-的存在;
故答案为:K+、OH-、CO32-、SO42-;Cl-;实验②中加入盐酸引入了Cl-,干扰了原溶液中Cl-的检验;
(2)取③中的上层清液继续滴加Ba(NO3)2溶液至不再产生沉淀,发生Ba2++SO42-=BaSO4↓;该沉淀为BaSO4,向上层清液中再滴加AgNO3溶液.产生白色沉淀为氯化银,实验②中加入盐酸引入了Cl-,干扰了原溶液中Cl-的检验,
故答案为:Ba2++SO42-=BaSO4↓.
故答案为:K+、OH-、CO32-、SO42-;Cl-;实验②中加入盐酸引入了Cl-,干扰了原溶液中Cl-的检验;
(2)取③中的上层清液继续滴加Ba(NO3)2溶液至不再产生沉淀,发生Ba2++SO42-=BaSO4↓;该沉淀为BaSO4,向上层清液中再滴加AgNO3溶液.产生白色沉淀为氯化银,实验②中加入盐酸引入了Cl-,干扰了原溶液中Cl-的检验,
故答案为:Ba2++SO42-=BaSO4↓.
点评:本题考查常见离子的检验,切入点是实验现象,根据实验现象和结合离子的性质综合分析是解答本题的关键,题目难度中等.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
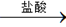 测定生成气体的体积
测定生成气体的体积
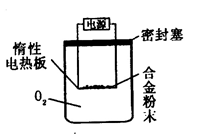
 测定生成气体的体积
测定生成气体的体积