题目内容
某同学设计了一种电解法制取Fe(OH)2的实验装置(如右图)。通电后,溶液中产生白色沉淀,且较长时间不变色。下列说法中正确的是

- A.电源中“a”为负极,“b”为正极
- B.电解池中的电解液不可以是NaCl溶液
- C.B电极发生的反应:2H­2O+2e-=H2↑+2OH-
- D.A.B两端都必须使用铁作电极
C
试题分析:阳极产生亚铁离子,阴极产生氢气,由于产生的氢气可以排出溶解在溶液中的少量氧气,故应B极产生氢气,所以A极为阳极,其电极材料为Fe,B极为阴极,其材料无条件限制,即a为正极,b为负极,故A、D项都是错误的。电解质溶液若为NaCl溶液,电解初期阳极产生的亚铁离子进入溶液,此时不会生成氢氧化亚铁,而阴极产生的氢气可以排出溶液中溶解的少量氧气,随电解的进行,溶液碱性增强,将生成氢氧化亚铁,故B项错误,因此正确的答案选C。
考点:考查电解池的原理及其应用。
点评:本题是高考中的常见题型,难度较大。主要是培养学生分析、归纳、判断、推理能力,提高学生的答题能力,激发学生的学习兴趣。
试题分析:阳极产生亚铁离子,阴极产生氢气,由于产生的氢气可以排出溶解在溶液中的少量氧气,故应B极产生氢气,所以A极为阳极,其电极材料为Fe,B极为阴极,其材料无条件限制,即a为正极,b为负极,故A、D项都是错误的。电解质溶液若为NaCl溶液,电解初期阳极产生的亚铁离子进入溶液,此时不会生成氢氧化亚铁,而阴极产生的氢气可以排出溶液中溶解的少量氧气,随电解的进行,溶液碱性增强,将生成氢氧化亚铁,故B项错误,因此正确的答案选C。
考点:考查电解池的原理及其应用。
点评:本题是高考中的常见题型,难度较大。主要是培养学生分析、归纳、判断、推理能力,提高学生的答题能力,激发学生的学习兴趣。

练习册系列答案
相关题目
 某同学设计了一种用电解法制取Fe(OH)2的试验装置如图.通电后,溶液中产生白色沉淀,且较长时间内不变色,下列说法中正确的是( )
某同学设计了一种用电解法制取Fe(OH)2的试验装置如图.通电后,溶液中产生白色沉淀,且较长时间内不变色,下列说法中正确的是( )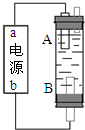 某同学设计了一种电解法制取Fe(OH)2的实验装置(如图).通电后,溶液中产生白色沉淀,且较长时间不变色.下列说法中正确的是( )
某同学设计了一种电解法制取Fe(OH)2的实验装置(如图).通电后,溶液中产生白色沉淀,且较长时间不变色.下列说法中正确的是( )




