题目内容
1.标准状况下,两种常见气态烃的混合物5.6L充分燃烧,生成10.08LCO2(标准状况)和5.4g水,则下列说法正确的是( )| A. | 混合烃的质量为5g | |
| B. | 两者分别是C2H6和C2H4,体积比为1:1 | |
| C. | 两者分别是CH4和C2H2,体积比为1:4 | |
| D. | 肯定没有甲烷 |
分析 标况下5.6L混合气体的物质的量为:$\frac{5.6L}{22.4L/mol}$=0.25mol,生成的二氧化碳的物质的量为:$\frac{10.08L}{22.4L/mol}$=0.45mol,生成水的物质的量为:$\frac{5.4g}{18g/mol}$=0.3mol,据此可以计算出混合烃的平均分子式,然后质量守恒计算出混合气体的平均相对分子量,根据计算结果对各选项进行判断.
解答 解:标况下5.6L混合烃的物质的量为0.25mol,生成的二氧化碳和水的物质的量分别为0.45mol、0.3mol,所以混合烃中含有碳原子平均数为:$\frac{0.45mol}{0.25mol}$=1.8,
含有氢原子的平均数为:$\frac{0.3mol×2}{0.25mol}$=2.4,混合气体的平均分子式为:C1.8H2.4,所以混合气体中一定含有甲烷,由于甲烷中氢原子数为4,则另一种烃中含有的氢原子数目一定小于2.4,则另一种烃只能为乙炔,
A、混合烃的质量为0.45mol×12g/mol+0.3mol×2g/mol=6g,故A错误;
B、由分析可知混合气体是乙炔和甲烷,故B错误;
C、设甲烷的物质的量为x,乙炔的物质的量为y,根据碳原子守恒,x+2y=1.8(x+y),解得x:y=1:4,故C正确;
D、由分析可知一定有甲烷,故D错误;
故选:C.
点评 本题考查了有机物分子式的确定,题目难度中等,注意掌握确定有机物分子式的计算方法,根据质量守恒定律确定碳原子、氢原子的数目是解题关键,明确气体的相对密度的含义及计算方法.

练习册系列答案
相关题目
12.某澄清透明溶液,当溶液呈强酸性时,有气体放出,当溶液呈强碱性时,有白色沉淀生成.则该溶液中可能大量共存的离子组是( )
| A. | K+、Ba2+、NO3-、S2- | B. | NH4+、Fe3+、Cl-、ClO- | ||
| C. | Na+、Al3+、S2-、CH3COO- | D. | K+、Ca2+、Br-、HCO3- |
9.有a、b、c、d 四瓶无色溶液,它们分别是Ba(OH)2溶液,NaHCO3溶液、MgCl2溶液、稀硫酸中的某一种.现各取少量溶液进行两两混合,实验现象如表所示,表中“↓”表示生成沉淀;“↑”表示生成气体;“一”表示无明显现象.下列推理不正确的是.( )
| ﹨ | a | b | c | d |
| a | ﹨ | ↓ | ↑ | - |
| b | ↓ | ﹨ | ↓ | ↓ |
| c | ↑ | ↓ | ﹨ | - |
| d | - | ↓ | - | ﹨ |
| A. | c一定是稀硫酸 | B. | d一定是MgCl2溶液 | ||
| C. | a可能是NaHCO3溶液 | D. | b一定是Ba(OH)2溶液 |
16.与棉纤维的化学组成不相似的纤维是( )
| A. | 人造毛 | B. | 粘胶纤维 | C. | 毛涤纶 | D. | 麻 |
6.下列离子方程式正确的是( )
| A. | 硫酸氢铵和氢氧化钠等物质的量混合 NH4++OH-═NH3↑+H2O | |
| B. | 碳酸氢钙与过量氢氧化钙溶液反应:Ca2++HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 实验室浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++H2O | |
| D. | 氯气与氢氧化钠溶液反应:Cl2+2OH-═Cl-+ClO-+H2O |
10.下列化合物沸点比较错误的是( )
| A. | 丙三醇>丙二醇>丙醇 | B. | 正戊烷>异戊烷>新戊烷 | ||
| C. | 丙醇>乙醇>甲醇>丁烷 | D. | 对二甲苯>邻二甲苯>间二甲苯 |
11.某有机物的结构简式为CH2=C(CH3)-CHO,它不能发生的反应的是( )
| A. | 加成反应 | B. | 聚合反应 | C. | 消去反应 | D. | 银镜反应 |
 有机物A是一种含溴的酯,分子式为C6H9O2Br,已知有如下的转化关系:
有机物A是一种含溴的酯,分子式为C6H9O2Br,已知有如下的转化关系: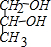 或HOCH2CH2CH2OH.
或HOCH2CH2CH2OH.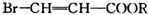 (R表示烃基)的有2种.
(R表示烃基)的有2种.