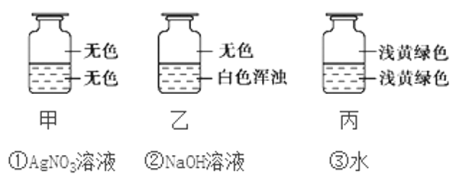
题目内容
【题目】按要求回答:
(1)Fe2O3+2Al![]() Al2O3+2Fe,在该反应中________元素的化合价升高,该元素的原子____电子(得到或失去),_____________是氧化剂,______________是还原剂,________是还原产物,________是氧化产物。(填化学式)
Al2O3+2Fe,在该反应中________元素的化合价升高,该元素的原子____电子(得到或失去),_____________是氧化剂,______________是还原剂,________是还原产物,________是氧化产物。(填化学式)
(2)标出下列化合物中指定元素的化合价。
KMnO4中Mn元素的化合价__________,KClO3中Cl元素的化合价__________。
【答案】铝 失去 Fe2O3 Al Fe Al2O3 +7 +5
【解析】
(1)在该反应Fe2O3+2Al![]() Al2O3+2Fe中Al元素的化合价从0价升高到+3价,该元素的原子失去电子,Al是还原剂,Al2O3是氧化产物;Fe元素化合价从+3价降低到0价,得到电子,Fe2O3是氧化剂,Fe是还原产物。
Al2O3+2Fe中Al元素的化合价从0价升高到+3价,该元素的原子失去电子,Al是还原剂,Al2O3是氧化产物;Fe元素化合价从+3价降低到0价,得到电子,Fe2O3是氧化剂,Fe是还原产物。
(2)KMnO4中K是+1价,O是-2价,根据正负价代数和为0可知Mn元素的化合价为+7价。KClO3中K是+1价,O是-2价,根据正负价代数和为0可知Cl元素的化合价是+5价。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案【题目】I.(1)键线式![]() 表示的有机物名称为__________。
表示的有机物名称为__________。
(2)A和B两种有机物可以互溶,其有关性质如表所示:
密度(20℃) | 熔点(℃) | 沸点(℃) | 溶解性 | |
A | 0.7137 g/mL | -116.6 | 34.5 | 不溶于水 |
B | 0.7893 g/mL | -117.3 | 78.5 | 与水以任意比混溶 |
要除去B中混有的少量A,可采用_________方法。
A.蒸馏 B.过滤 C.萃取 D.加水充分振荡,分液
Ⅱ.(1)扁桃酸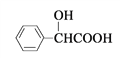 有多种同分异构体,属于甲酸酯且含酚羟基的同分异构体共有_______种。
有多种同分异构体,属于甲酸酯且含酚羟基的同分异构体共有_______种。
(2)分子式为C9H12 且属于苯的同系物的同分异构体的数目为_______
III.有下列各组物质:
(A)S2和S4
(B) ![]() 和
和![]()
(C)CH4和C8H18
(D) 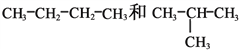
(E)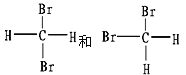
①_________组两物质互为同素异形体;
②_________组两物质互为同系物
IV.配平下列化学方程式,只需将配平后草酸的系数、二氧化氯的系数填入答题页上。
KClO3+______H2C2O4+H2SO4![]() _____ClO2↑+K2SO4+CO2↑+H2O
_____ClO2↑+K2SO4+CO2↑+H2O