题目内容
气体的自动化检测中常常应用原电池原理的传感器。下图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。则下列说法中正确的是
| 待测气体 | 部分电极反应产物 |
| NO2 | NO |
| Cl2 | HCl |
| CO | CO2 |
| H2S | H2SO4 |
A.上述气体检测时,敏感电极均作电池正极
B.检测Cl2气体时,敏感电极的电极反应为:Cl2 + 2e-= 2Cl-
C.检测H2S气体时,对电极充入空气,对电极上的电极反应式为O2 + 2H2O+ 4e- = 4OH-
D.检测H2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同
B
解析试题分析:A. 对于检测NO2、Cl2气体时,气体得到电子,敏感电极均作电池正极,而对于检测CO、H2S气体时,气体失去电子,敏感电极均作电池负极 。错误。B. 检测Cl2气体时,敏感电极作正极,电极反应为:Cl2 + 2e-= 2Cl-,发生还原反应。正确。C.检测H2S气体时,由于是酸性环境,所以对电极充入空气,对电极上的电极反应式为O2 +4e- + 4H+= 2H2O.错误。D.检测H2S和CO体积分数相同的两份空气样本时,因为1molCO气体在反应中转移的电子的物质的量2mol,而H2S则是1mol气体在反应中转移的电子的物质的量8mol.所以传感器上产生的电流大小不相同。错误。
考点:考查原电池原理的传感器在气体的自动化检测中的应用的知识。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案铜锌原电池(如图)工作时,下列叙述正确的是( )
| A.正极反应为Zn-2e-=Zn2+ |
| B.电池反应为Zn+Cu2+=Zn2++Cu |
| C.在外电路中,电子从负极流向正极 |
| D.盐桥中的K+移向ZnSO4溶液 |
氢氧燃料电池可同时供应电和水蒸气,所用燃料为H2,电解质为熔融的K2CO3。已知该电池的正极反应为:O2+2CO2+4e-=2C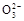 。下列叙述正确的是( )
。下列叙述正确的是( )
A.放电时C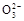 向正极移动 向正极移动 |
| B.放电时OH-向负极移动 |
C.负极反应为H2+C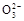 -2e-=H2O+CO2 -2e-=H2O+CO2 |
| D.当该电池产生的水蒸气折算成标准状况下的体积为22.4 L时,转移电子4 mol |
如图装置中,小试管内为红墨水,带有支管的U形管中盛有pH=4的雨水和生铁片。经观察,装置中有如下现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U形管中的液面。以下有关解释合理的是( )
| A.生铁片中的碳是原电池的负极,发生还原反应 |
| B.雨水酸性较强,生铁片始终发生析氢腐蚀 |
| C.墨水液面回升时,正极反应式为:O2+2H2O+4e-=4OH- |
| D.U形管中溶液pH逐渐减小 |
下列各组中,每种电解质溶液电解时只生成氢气和氧气的是( )
| A.HCl、CuCl2、Ba(OH)2 |
| B.NaOH、CuSO4、H2SO4 |
| C.NaOH、H2SO4、Ba(OH)2 |
| D.NaBr、H2SO4、Ba(OH)2 |
如图所示,将铁棒和石墨棒插入1 L 1 mol·L-1食盐水中。下列说法正确的是( )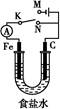
| A.若电键K与N连接,铁被保护不会腐蚀 |
| B.若电键K与N连接,正极反应式是:4OH--4e-=2H2O+O2↑ |
| C.若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜 |
| D.若电键K与M连接,当两极共产生28 L(标准状况)气体时,生成了1 mol NaOH |
下列有关金属保护方法的说法中正确的是( )
| A.我们使用的快餐杯表面有一层搪瓷,搪瓷层破损后仍能起到防止铁生锈的作用 |
| B.白铁(镀锌铁)镀层破损后,铁皮的腐蚀速率很慢 |
| C.轮船的船壳水线以下常装有一些锌块,这是利用了牺牲阴极的阳极保护法 |
| D.钢铁制造的暖气管道外常涂有一层沥青,这是钢铁的电化学保护法 |
小军利用家中的废旧材料制作了一个可使玩具扬声器发出声音的电池,装置如图所示。下列有关该电池工作时的说法错误的是( )
| A.铝质汽水罐将逐渐被腐蚀 |
| B.电子流向为铝质汽水罐→导线→扬声器→导线→木炭棒 |
| C.食盐水中的Na+向木炭棒移动 |
| D.木炭棒上发生的反应为2H++2e-=H2↑ |
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列关于该燃料电池的叙述不正确的是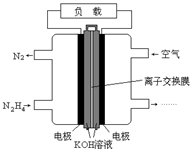
| A.电流从右侧电极经过负载后流向左侧电极 |
| B.负极发生的电极反应式为:N2H4 + 4OH- - 4e - = N2+ 4H2O |
| C.该燃料电池的电极材料应采用多孔导电材料, 以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 |
| D.该燃料电池持续放电时,正极发生氧化反应,PH减小 |