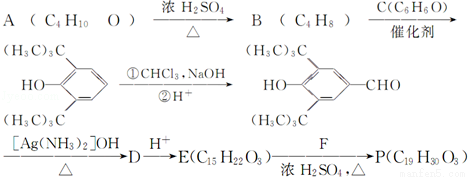
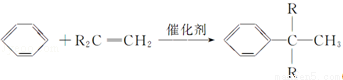
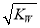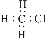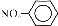题目内容
(4分)(2012?广东)设nA为阿伏加德罗常数的数值,下列说法正确的是( )
A.常温下,4g CH4含nA个C﹣H共价键
B.1 mol Fe与足量稀HNO3反应,转移个2nA个电子
C.1L 0.1 mol/L NaHCO3溶液中含有0.1nA个HCO3﹣
D.常温常压下,22.4L的NO2和CO2混合气体含有2nA个O原子
A
【解析】A、质量换算物质的量结合甲烷分子结构计算碳氢键;
B、足量稀硝酸与铁反应生成三价铁;
C、碳酸氢根离子水解;
D、依据气体摩尔体积的应用条件是标准状况分析;
【解析】
A、4g CH4物质的量为0.25mol,分子中含C﹣H共价键4×0.25×nA=nA个,故A正确;
B、稀硝酸过量,生成硝酸铁,转移电子应该是3 nA个电子,故B错误;
C、碳酸氢根离子水解,应该是小于0.1nA个HCO3﹣;故C错误;
D、条件错误,应为标准状况,故D错误;
故选A.

 名校通行证有效作业系列答案
名校通行证有效作业系列答案[15分]甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
反应过程 | 化学方程式 | 焓变△H (kJ/mol) | 活化能Ea (kJ/mol) |
甲烷氧化 | CH4(g)+2O2(g) | -802.6 | 125.6 |
CH4(g)+O2(g) | -322.0 | 172.5 | |
蒸汽重整 | CH4(g)+H2O(g) | 206.2 | 240.1 |
CH4(g)+2H2O(g) | 165.0 | 243.9 |
回答下列问题:
(1)反应CO(g)+H2O(g) CO2(g)+H2(g)的△H= kJ/mol。
CO2(g)+H2(g)的△H= kJ/mol。
(2)在初始阶段,甲烷蒸汽重整的反应速率 甲烷氧化的反应速率(填大于、小于或等于)。
(3)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可以平衡常数(记作KP),则反应CH4(g)+H2O(g) CO(g)+3H2(g)的KP= ;
CO(g)+3H2(g)的KP= ;
随着温度的升高,该平衡常数 (填“增大”、“减小”或“不变”)。
(4)从能量阶段分析,甲烷自热重整方法的先进之处在于 。
(5)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如下图:

①若要达到H2物质的量分数>65%、CO的物质的量分数<10%,以下条件中最合适的是 。
A.600℃,0.9MpaB.700℃,0.9MPaC.800℃,1.5MpaD.1000℃,1.5MPa
②画出600℃,0.1Mpa条件下,系统中H2物质的量分数随反应时间(从常温进料开始即时)
的变化趋势示意图:

(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是 。
(16分)(2012?广东)碘在科研与生活中有重要作用,某兴趣小组用0.50mol?L﹣1KI、0.2%淀粉溶液、0.20mol?L﹣1K2S2O8、0.10mol?L﹣1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
已知:S2O82﹣+2I﹣=2SO42﹣+I2(慢) I2+2S2O32﹣=2I﹣+S4O62﹣ (快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的 耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32﹣与S2O82﹣初始的物质的量需满足的关系为:n(S2O32﹣):n(S2O82﹣) .
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验 序号 | 体积V/ml | ||||
K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中Vx= ml,理由是 .
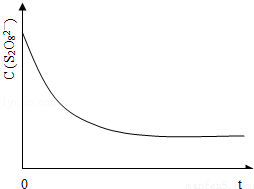
(3)已知某条件下,浓度c(S2O82﹣)~反应时间t的变化曲线如图13,若保持其它条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82﹣)~反应时间t的变化曲线示意图(进行相应的标注).
(4)碘也可用作心脏起捕器电源﹣锂碘电池的材料,该电池反应为:2Li(s)+I2 (s)=2LiI(s)△H
已知:4Li(s)+O2 (g)=2Li2O(s)△H1
4LiI(s)+O2 (g)=2I2 (s)+2Li2O(s)△H2
则电池反应的△H= ;碘电极作为该电池的 极.