题目内容
有一瓶100ml硫酸和硝酸的混合溶液,取出10.00ml该混合溶液,加入足量氯化钡溶液,充分反应后过滤、洗涤、烘干,得4.66g沉淀。滤液跟2.00mol/L的NaOH溶液反应共用去35.00mlNaOH溶液时恰好使溶液呈中性,则混合酸中硫酸和硝酸的物质的量的浓度是多少?
c(H2SO4)=2.00mol/L c(HNO3)=3.00mol/L
试题分析:硫酸与硝酸的混合溶液,取出10mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到4.66g的沉淀为硫酸钡,根据n=
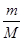 计算硫酸钡的物质的量,再根据硫酸根守恒n(H2SO4)=n(BaSO4),滤液中氢离子物质的量不变,与2.0mol?L-1NaOH溶液反应,用去35mL碱液时恰好完全中和,酸与氢氧化钠恰好反应,H+与OH-1:1反应,故n(HNO3)+2(H2SO4)=n(NaOH),根据c=
计算硫酸钡的物质的量,再根据硫酸根守恒n(H2SO4)=n(BaSO4),滤液中氢离子物质的量不变,与2.0mol?L-1NaOH溶液反应,用去35mL碱液时恰好完全中和,酸与氢氧化钠恰好反应,H+与OH-1:1反应,故n(HNO3)+2(H2SO4)=n(NaOH),根据c=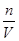 计算硫酸、硝酸的物质的量浓度。
计算硫酸、硝酸的物质的量浓度。解:硫酸与硝酸的混合溶液,取出10mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到4.66g的沉淀为硫酸钡,硫酸根守恒,故n(H2SO4)=n(BaSO4)=4.66g÷233g/mol=0.02mol
故原溶液中c(H2SO4)=0.02mol÷0.01L=2.00mol/L
滤液中氢离子物质的量不变,与2.0mol?L-1NaOH溶液反应,用去35mL碱液时恰好完全中和,酸与氢氧化钠恰好反应,H+与OH-1:1反应
故n(HNO3)+2(H2SO4)=n(NaOH)
即n(HNO3)+2×0.02mol=0.035L×2mol/L
解得n(HNO3)=0.03mol
所以原溶液中c(HNO3)=0.03mol÷0.01L=3.00mol/L,

练习册系列答案
相关题目