题目内容
14.下列条件能够判断可逆反应2N2+3H2?2NH3已经达到平衡的是( )| A. | 反应停止 | B. | N2、H2、NH3的浓度均相等 | ||
| C. | N2、H2、NH3的浓度保持不变 | D. | N2的消耗速率等于NH3的生成速率 |
分析 根据化学反应到达平衡时,正逆反应速率相等,各物质的物质的量浓度不再发生变化来进行判断.
解答 解:A、因反应达到平衡时,正逆反应速率相等,但反应并没有停止,故A错误;
B、因反应平衡时各物质的浓度不变,但不是说各自的浓度相等,故B错误;
C、因达到平衡时,正逆反应速率相等,各种物质的浓度不再发生变化,故C正确;
D、N2的消耗速率等于NH3的生成速率,都上指的为正反应方向,故D错误;
故选:C.
点评 本题考查平衡状态的判断,对于反应前后气体的计量数之和不相等的可逆反应来说,可从浓度、压强、百分含量等角度判断是否达到平衡状态.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.科研人员设想用如图所示装置生产硫酸,下列说法正确的是( )


| A. | a为正极,b为负极 | |
| B. | 负极反应式为:2H2O+SO2-2e-═SO42-+4H+ | |
| C. | 电子从b极向a极移动 | |
| D. | 生产过程中H+向a电极区域运动 |
5.下列离子方程式中,正确的是( )
| A. | 大理石溶解于醋酸 CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 澄清石灰水中加入CuSO4溶液混合 2OH-+Cu2+═Cu(OH)2↓ | |
| C. | NaHSO4溶液和Na2CO3溶液混合 2H++CO32-═CO2↑+H2O | |
| D. | NaHSO4溶液中加入Ba(OH)2═Ba2++SO42-═BaSO4↓ |
2.下列有关离子浓度的比较正确的是的( )
| A. | 0.1mol•L-1氨水中,c(OH-)<c(NH4+) | |
| B. | 10mL 0.02mol•L-1HCl溶液与10mL 0.02mol•L-1Ba(OH)2溶液充分混合,c(Cl-)>c(Ba2+)>c(OH-)=c(H+) | |
| C. | 将0.1mol•L-1CH3COONa和0.1mol•L-1NH4Cl等体积混合后的溶液中,c(H+)+c(CH3COOH)>c(NH3•H2O)+c(OH-) | |
| D. | 0.1mol•L-1某二元弱酸碱性NaHA溶液中,c(H+)+c(H2A)═c(A2-)+c(OH-) |
9.下列关于能层与能级的说法中正确的是( )
| A. | 原子核外电子的每一个能层最多可容纳的电子数为2n2 | |
| B. | 任一能层的能级总是从s能级开始,而且能级数不一定等于该能层序数 | |
| C. | 同是s能级,在不同的能层中所能容纳的最多电子数是不相同的 | |
| D. | 1个原子轨道里最多只能容纳2个电子,但自旋方向相同 |
19.下列物质:①丙氨酸 ②纤维素 ③蛋白质 ④小苏打 ⑤Al(OH)3 ⑥苯酚钠 ⑦CH3COONH4.其中既能与盐酸反应又能与NaOH反应的是( )
| A. | ①③④⑤⑦ | B. | 全部 | C. | ①③④⑤⑥ | D. | ①④⑤⑥ |
6.下列溶液与50mL 0.2mol/L的MgCl2溶液中的Cl-的物质的量浓度相等的是( )
| A. | 150mL 0.4mol/L的HCl | B. | 250mL 0.2mol/L的AlCl3 | ||
| C. | 250mL 0.3mol/L的BaCl2 | D. | 100mL 0.2mol/L的NaCl |
3.某同学设计下列方法对A盐的水溶液进行鉴定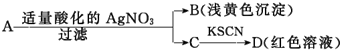
由此得出的结论中,不正确的是( )

由此得出的结论中,不正确的是( )
| A. | A一定是FeBr3 | B. | B为AgBr | ||
| C. | 滤液C中有Fe3+ | D. | D溶液中存在Fe(SCN)3 |
4.几种短周期元素的原子半径及主要化合价见下表:
根据表中信息,判断以下说法正确的是( )
| 元素符号 | X | Y | Z | R | T |
| 原子半径(nm) | 0.160 | 0.089 | 0.102 | 0.143 | 0.074 |
| 主要化合价 | +2 | +2 | -2、+4、+6 | +3 | -2 |
| A. | 单质与稀硫酸反应的速率快慢:R>Y>X | |
| B. | 离子半径:X2+>T2- | |
| C. | 元素最高价氧化物对应的水化物的碱性:R>X | |
| D. | 相同条件下,等物质的量的单质与氢气化合放出能量的多少:T>Z |