题目内容
(08广东实验中学三模) (16分)粗盐提纯的研究。化学式 | CaCO3 | CaSO3 | CaC2O4 | Mg(OH)2 |
Ksp | 4.96×10―9 | 4.96×10―9 | 2.34×10―9 | 5.61×10―12 |
【有关资料】
某研究性学习小组对粗盐的提纯和检验进行研究,并提出一些新的方案。已知该粗盐样品中主要含有不溶性杂质、Mg2+、Ca2+等(忽略SO42―的存在),该小组设计流程如下:
 【设计除杂过程】
【设计除杂过程】
(1)操作①中需要使用的玻璃仪器有 、 。操作②的名称为 ,若在操作②结束后发现溶液B略有浑浊,应采取的措施是 。
(2)混合液A的主要成分是 。(填化学式)
【检验除杂效果】
(3)为检验溶液B中Mg2+、Ca2+是否除尽,通常分别取少量溶液B于两支试管中,进行如下实验:
步骤一:检验Mg2+是否除尽。向其中一支试管中加入 溶液(填化学式),看是否有沉淀生成。
步骤一:检验Ca2+是否除尽。向另一支试管中加入某溶液,看是否有沉淀生成。效果最好的是 (填字母)。 A、Na2CO3 B、Na2SO
【获取纯净食盐】
(4)对溶液B加热并不断滴加6 mol?L―1的盐酸溶液,同时用pH试纸检测溶液,直至pH=2时停止加盐酸,得到溶液C。该操作的目的是 。
(5)将溶液C倒入 (填仪器名称)中,加热蒸发并用玻璃棒不断搅拌,直到
时(填现象),停止加热。
【问题讨论】
(6)在除杂过程中,向粗盐悬浊液中加混合液A时需要加热,目的是 ,
该操作中控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,溶液B中Mg2+物质的量浓度将被控制在 以下。
(2)NaOH、Na2CO3(2分) (3)NaOH C (2分,各1分)
(4)除去NaOH和Na2CO3(2分) (5)蒸发皿,蒸发皿中有大量固体析出(2分,各1分)
(6)加快沉淀生成 5.61×10―8 mol?L―1。(4分,各2分)

(08广东实验中学三模)(7分)某化学小组的同学到实验室学习。在实验桌上摆有下列仪器:
 |
(1)指导教师要求同学们写出仪器的名称,甲同学书写的答案如下表,请你找出其中的错误,将改正后的名称填写在下表中(若正确,则该空不需要填写。)
仪器编号 | a | b | c | d | e |
名称 | 试管 | 溶量瓶 | 集气瓶 | 碱式滴定管 | 普通漏斗 |
改正的名称 |
|
|
|
|
|
(2)关于e的用途,乙同学说:组成防倒吸装置。你还能说出
① ;② 。
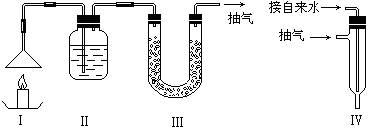
(3)丙同学想用下图装置以大理石和稀盐酸反应制取CO2。
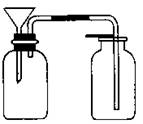 教师指出,这需要太多的稀盐酸,造成浪费。该同学选用了上面的一种仪器,加在装置上,解决了这个问题。请你把该仪器画在图中合适的位置。
教师指出,这需要太多的稀盐酸,造成浪费。该同学选用了上面的一种仪器,加在装置上,解决了这个问题。请你把该仪器画在图中合适的位置。
(08广东实验中学三模)碳酸锰(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业。一种制备MnCO3的生产流程如下图所示。
 |
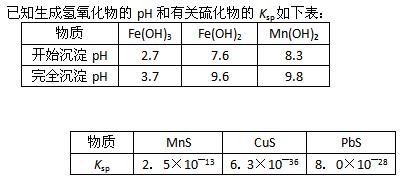
软锰矿主要成分为MnO2,其中含有铁、铝、硅的氧化物和少量重金属化合物杂质,SO2来自工业废气。流程①中主要发生的反应有:MnO2 + SO2 = MnSO4 2Fe3+ + SO2 + 2H2O = 2Fe2+ + SO42― + 4H+
(1)流程①中所得MnSO4溶液的pH比软锰矿浆的pH (填“大”或“小”)该流程可与__(填工业生产名称)联合,生产效益更高。
(2)反应②的目的是将溶液中的Fe2+氧化成Fe3+,其离子反应方程式为 ,这样设计的目的和原理是
(3)反应③中硫化钠的作用是使重金属离子转化为硫化物沉淀,碳酸钙的作用是 。
(4)反应④发生的化学反应为:MnSO4 + 2NH4HCO3 = MnCO3↓+ (NH4)2SO4 + CO2↑ + H2O。
反应中通常需加入稍过量的NH4HCO3 ,且控制溶液的pH为6.8~7.4。加入稍过量的NH4HCO3的目的是 ,溶液的pH不能过低的原因是 。
((5)软锰矿中锰的浸出有两种工艺:工艺A:软锰矿浆与含SO2的工业废气反应 工艺B:软锰矿与煤碳粉混合,焙烧后加稀硫酸溶解。
其中工艺A的优点是 。(答对1个即可)
(10分)TBC是优良的增塑剂,具有很好的相容性,且挥发性小、耐寒、耐光及耐水等,广泛用于医学卫生用品,它的结构式如下图,合成时柠檬酸与正丁醇合成数据如下:
下表中实验数据均为用活性炭固体杂多酸作催化剂,实验时催化剂总量占原料的1%,实验结果如下表。表1:酸醇物质的量之比对酯化率的影响;表2:酯化时间对酯化率的影响;表3:酯化率随温度变化情况。
表1 | n(酸)n(醇) | 15.0 | 15.5 | 16.0 | 16.5 | 17.0 |
酯化率/% | 95.1 | 96.3 | 97.0 | 97.4 | 97.2 | |
表2 | 时间/h | 0.5 | 1.0 | 2.0 | 3.0 | 5.0 |
酯化率/% | 40.0 | 70.2 | 94.3 | 97.4 | 97.4 | |
表3 | 温度/℃ | 130 | 140 | 145 | 150 | 160 |
酯化率/% | 89.5 | 96.2 | 97.4 | 97.4 | 97.2 |
试回答下列问题
(1)酯化反应适宜的条件n(酸)∶(醇)、时间/h、温度/℃分别是: (选填序号)。
 A.1∶5,1,130 B.1∶5.5 ,1,140
A.1∶5,1,130 B.1∶5.5 ,1,140
C.1∶7 ,2,160 D.1∶6.5 ,3,145
(2)温度太高酯化率降低的可能原因是
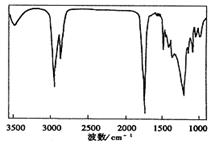
(3)TBC的一种标准谱图如右,它是
(A、1H-NMR图谱 B、红外光谱 C、质谱)
(4)TBC与足量NaOH溶液反应的化学方程式: 。(5)柠檬酸的一种同分异构体A,能发生如下转化: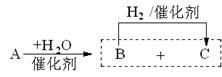
A可能的结构式为: (只写一种)。
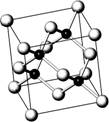 (08广东实验中学三模)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措,已知砷化镓的晶胞结构如右图。试回答下列问题
(08广东实验中学三模)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措,已知砷化镓的晶胞结构如右图。试回答下列问题