��Ŀ����
����Ŀ��25��ʱ����ʢ��50mL pH=2��HA��Һ�ľ��������м���pH=13��NaOH��Һ������NaOH��Һ�������V�������û����Һ���¶ȣ�T���Ĺ�ϵ��ͼ��ʾ������������ȷ���ǣ� �� 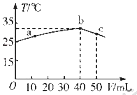
A.HA��Һ�����ʵ���Ũ��Ϊ0 0l mol��L��1
B.b��c�Ĺ����У��¶Ƚ��͵�ԭ������Һ�з��������ȷ�Ӧ
C.a��b�Ĺ����У������Һ�п��ܴ��ڣ�c��A����=c��Na+��
D.25��ʱ��HA�ĵ���ƽ�ⳣ��KԼΪ1.43��10��2
���𰸡�C
���������⣺A��ǡ���к�ʱ�����Һ�¶���ߣ���b�㣬��ʱ������������=0.04L��0.1mol/L=0.004mol���ó�50mlHA��Ũ��= ![]() =0.08mol/L����A����
=0.08mol/L����A����
B��b��c�Ĺ����У��¶Ƚ��͵�ԭ������Һ�з����˷�Ӧǡ������NaA�������μ�����������Һ���ٷ�����Ӧ����Һ�¶Ƚ��ͣ���B����
C��NaA�ʼ��ԣ�HA�����ԣ�a��b�Ĺ����У������Һ�п��ܳ����ԣ����ڣ�c��A����=c��Na+������C��ȷ��
D������ƽ�ⳣ��K= ![]() =
= ![]() =1.43��10��3 �� ��D����
=1.43��10��3 �� ��D����
�ʴ�ѡC��

��ϰ��ϵ�д�
 ������ҵ����ν�����������ϵ�д�
������ҵ����ν�����������ϵ�д�
�����Ŀ