题目内容
实验室用Cu和稀硝酸反应制取NO气体,反应方程式如下:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O (1)19.2g Cu完全反应需消耗多少摩尔HNO3?有多少克HNO3被还原?
(2)在标准状况下产生的NO的体积为多少?
(2)在标准状况下产生的NO的体积为多少?
解:(1)∵ 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑+ 4H2O
3×64g 8mol
19.2g nmol
∴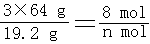
∴n = 0.8 mol
由方程式可知,8mol HNO3参加反应,其中只有2mol被还原。
∴ 消耗的0.8mol HNO3中有0.2mol被还原,即12.6g。
(2)∵ 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑+ 4H2O
3×64g 2×22.4L
19.2g VL
∴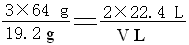
∴ V= 4.48L
3×64g 8mol
19.2g nmol
∴
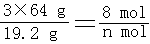
∴n = 0.8 mol
由方程式可知,8mol HNO3参加反应,其中只有2mol被还原。
∴ 消耗的0.8mol HNO3中有0.2mol被还原,即12.6g。
(2)∵ 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑+ 4H2O
3×64g 2×22.4L
19.2g VL
∴
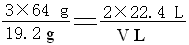
∴ V= 4.48L

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
 Mn2++2Cl2↑+2H2O
Mn2++2Cl2↑+2H2O
 +Ba2++2OH-═BaSO4↓+2H2O
+Ba2++2OH-═BaSO4↓+2H2O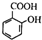 )混合:
)混合: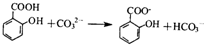


 Mn2++2Cl2↑+2H2O
Mn2++2Cl2↑+2H2O
 Cu2++NO↑+2H2O
Cu2++NO↑+2H2O +Ba2++2OH-═BaSO4↓+2H2O
+Ba2++2OH-═BaSO4↓+2H2O )混合:
)混合: