题目内容
1886年,德国夫赖堡(Frieberg)矿业学院的一位教授在分析夫赖堡附近发现的一种新矿石(以X表示,X为整比化合物)的时候,发现其中有一种当时未知的新元素(以Y表示,在X中Y的化合价为+4),并通过实验验证了自己的推断。经分析,X中含有银元素(化合价为+1)和硫元素(化合价为-2),其中Ag的质量分数为76.53%。在氢气流中加热X,可得到Ag2S、H2S和Y的低价硫化物(Y的化合价为+2)。如果在200℃和100kPa条件下完全转化16.0g的X需要0.557L的氢气。根据上面的描述:
(1)计算Y的摩尔质量并指出Y在元素周期表中的位置
(2)写出X的化学式
(3)写出氢气和X反应的化学方程式
(1)M(Y)=73 g· mol-1 第四周期ⅣA族
(2)X:Ag8GeS6 (3)Ag8GeS6+H2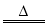 4Ag2S+GeS+H2S
4Ag2S+GeS+H2S
【解析】
试题分析:(1)设X的化学式为Ag2aYbSa+2b (或a Ag2S·bYS2)
216a/M(X)=0.7653 M(X)=216a/0.7653 1分
参加反应的H2的物质的量是n(H2)=100×0.557/473×8.31=0.01417mol(1分)
Ag2aYbSa+2b + bH2=aAg2S+bYS+bH2S(1分)
216a/0.7653 b
16.0 0.01417
a/b=4.00,因X是整比化合物,a、b都是正整数,得a=4,b=1,
M(Y)=73 g· mol-1(2分)
查元素周期表可得Y为Ge元素,它的位置是第四周期ⅣA族(1分)
(2)X:Ag8GeS6(2分)
(3)Ag8GeS6+H2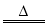 4Ag2S+GeS+H2S(2分)
4Ag2S+GeS+H2S(2分)
考点:元素周期表和摩尔质量的计算。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案