题目内容
7.化学与环境、材料、信息、能源关系密切,下列说法不正确的是( )| A. | 水玻璃可用作木材的防火剂 | |
| B. | Na2O2可用于潜水员的呼吸面具中的供氧剂 | |
| C. | 对“地沟油”蒸馏可以获得汽油 | |
| D. | 石英具有很好的导光性,可用于生产光导纤维 |
分析 A、水玻璃是硅酸钠的水溶液,硅酸钠不燃烧,受热不分解;
B、过氧化钠和二氧化碳水蒸气反应生成氧气;
C、地沟油是使用的植物油;
D、石英的主要成分为二氧化硅,具有良好的导光性;
解答 解:A.水玻璃是硅酸钠的水溶液,硅酸钠不燃烧,受热不分解,能作木材防火剂,故A正确;
B、过氧化钠和二氧化碳、水蒸气反应生成氧气,Na2O2可用于潜水员的呼吸面具中的供氧剂,故B正确;
C、地沟油主要成分是高级脂肪酸甘油酯,汽油是烃,故C错误;
D、石英的主要成分为二氧化硅,具有良好的导光性,所以可用于生产光导纤维,故D正确;
故选C.
点评 本题考查了二氧化硅的性质以及地沟油的利用等知识点,注意掌握知识基础是解题关键,题目较简单.

练习册系列答案
相关题目
17.某有机物的结构简式如下所示,该有机物可能具有的性质是( )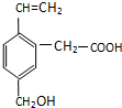
①可以燃烧
②能使酸性KMnO4溶液褪色
③能跟NaOH溶液反应
④能发生酯化反应
⑤能发生加成反应.

①可以燃烧
②能使酸性KMnO4溶液褪色
③能跟NaOH溶液反应
④能发生酯化反应
⑤能发生加成反应.
| A. | 只有②③④ | B. | 只有①②③④ | C. | ①②③④⑤ | D. | 只有②④ |
18.SiO2是一种化工原料,可以制备一系列物质(见图).下列说法错误的是( )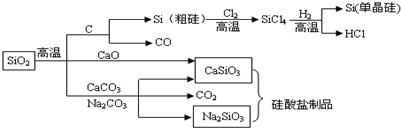

| A. | 图中所有的反应中,属于氧化还原反应的有3个 | |
| B. | 用硫酸可以除去石英砂(主要成分是SiO2)中少量的碳酸钙 | |
| C. | 工业制水泥、工业制玻璃、燃煤固硫等都用到原料石灰石 | |
| D. | 纯净的二氧化硅和单晶硅都是信息产业的重要基础原料,高纯度二氧化硅的广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
15.下列说法中正确的是( )
| A. | 金属导电的原因是在外加电场的作用下金属产生自由电子,电子定向运动 | |
| B. | 金属晶体的熔点和沸点都很高 | |
| C. | 金属元素和非金属元素形成的化合物一定是离子化合物 | |
| D. | 离子化合物中一定含有离子键 |
2.下列混合物,不论它们以何种比例混合,只要总质量一定,经完全燃烧后产生二氧化碳和水的量也一定的是( )
| A. | 乙炔和乙苯 | B. | 甲烷和乙烷 | ||
| C. | 乙醛和丙酮 | D. | 乙酸和乳酸[CH3CH(OH)COOH] |
12.其它条件不变,升高温度下列数据不一定增大的是( )
| A. | 可逆反应的化学平衡常数K | B. | 0.1mol/LCH3COONa溶液的PH | ||
| C. | 水的离子积常数Kw | D. | 弱电解质的电离程度 |
16.下列叙述错误的是( )
| A. | 阴、阳离子通过静电吸引所形成的化学键,叫离子键 | |
| B. | 活泼金属元素与活泼非金属元素化合时,形成的是离子键 | |
| C. | 某元素最外层只有一个电子,它与卤素原子结合时所形成的化学键不一定是离子键 | |
| D. | 全部由非金属元素组成的化合物可能是离子化合物 |
17. A-F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:请回答下列问题:
A-F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:请回答下列问题:
(1)A在元素周期表中的位置是第3周期ⅡA族;A与E形成的化合物的电子式是 .
.
(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是2Fe3++Cu═2Fe2++Cu2+.
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是C+H2O $\frac{\underline{\;高温\;}}{\;}$ CO+H2.
(4)F的盐酸盐水溶液呈酸性,原因是Al3++3H2O?Al(OH)3+3H+(用离子方程式表示);F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是2Al+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3.
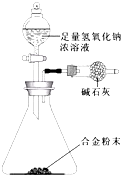
(5)A与F形成的合金是重要的工业材料.某同学仅使用天平和如图所示的装置,粗略测定某些数据即可求出该合金中A元素的含量.(装置中因空气质量引起的误差忽略不计)
①实验需要测定三个物理量:合金的质量m以及a和b.a是反应前装置和药品的总质量;b是反应后装置和药品的总质量.
②合金中A元素的质量分数是$\frac{4m-36a+36b}{m}$(用含m、a、b的式子表示).
 A-F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:请回答下列问题:
A-F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:请回答下列问题:| 元素 | 结构或性质 |
| A | 原子最外层电子数是内层电子总数的$\frac{1}{5}$ |
| B | 形成化合物种类最多的元素,其单质为固体 |
| C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D | 地壳中含量最多的元素 |
| E | 与D同主族 |
| F | 与E同周期,且最外层电子数等于电子层数 |
 .
.(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是2Fe3++Cu═2Fe2++Cu2+.
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是C+H2O $\frac{\underline{\;高温\;}}{\;}$ CO+H2.
(4)F的盐酸盐水溶液呈酸性,原因是Al3++3H2O?Al(OH)3+3H+(用离子方程式表示);F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是2Al+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3.
(5)A与F形成的合金是重要的工业材料.某同学仅使用天平和如图所示的装置,粗略测定某些数据即可求出该合金中A元素的含量.(装置中因空气质量引起的误差忽略不计)
①实验需要测定三个物理量:合金的质量m以及a和b.a是反应前装置和药品的总质量;b是反应后装置和药品的总质量.
②合金中A元素的质量分数是$\frac{4m-36a+36b}{m}$(用含m、a、b的式子表示).
 ,在催化剂存在条件下1molD与2molH2反应可以生成乙;丙中含有两个-CH3
,在催化剂存在条件下1molD与2molH2反应可以生成乙;丙中含有两个-CH3
 .
. .
.