题目内容
离子化合物A2B3是由短周期元素A和B形成,已知A3+离子比B2-离子少一个电子层,以下推断正确的是( )
分析:由两种短周期元素A和B形成的离子化合物A2B3,A3+离子比M2-离子少一个电子层,则A和M都属于第三周期,可推知A是Al元素,B是S元素,A的最高价氧化物的水化物是Al(OH)3,是两性氢氧化物,主族元素电子层数=周期数、主族族序数=最外层电子数,据此确定S元素在周期表中的位置.
解答:解:由两种短周期元素A和B形成的离子化合物A2B3,A3+离子比M2-离子少一个电子层,则A和M都属于第三周期,可推知A是Al元素,B是S元素,
A.根据以上分析知化合物A2B3是Al2S3,故A错误;
B.铝离子的结构示意图为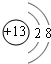 ,硫离子的结构示意图为
,硫离子的结构示意图为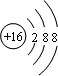 ,二者最外电子层上的电子数都是8,故B正确;
,二者最外电子层上的电子数都是8,故B正确;
C.A的最高价氧化物的水化物是Al(OH)3,是两性氢氧化物,属于弱电解质,故C错误;
D.B是S元素,其原子结构示意图为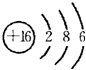 ,电子层数等于其周期数,最外层电子数等于与其族序数相等,所以S元素位于第三周期第VIA族,故D错误;
,电子层数等于其周期数,最外层电子数等于与其族序数相等,所以S元素位于第三周期第VIA族,故D错误;
故选B.
A.根据以上分析知化合物A2B3是Al2S3,故A错误;
B.铝离子的结构示意图为
 ,硫离子的结构示意图为
,硫离子的结构示意图为 ,二者最外电子层上的电子数都是8,故B正确;
,二者最外电子层上的电子数都是8,故B正确;C.A的最高价氧化物的水化物是Al(OH)3,是两性氢氧化物,属于弱电解质,故C错误;
D.B是S元素,其原子结构示意图为
 ,电子层数等于其周期数,最外层电子数等于与其族序数相等,所以S元素位于第三周期第VIA族,故D错误;
,电子层数等于其周期数,最外层电子数等于与其族序数相等,所以S元素位于第三周期第VIA族,故D错误;故选B.
点评:本题考查了元素位置结构性质的相互关系及应用,正确推断元素是解本题关键,结合原子、离子的结构来分析解答,难度中等.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目