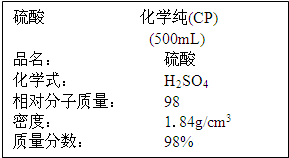
题目内容
现将10mL18mol/L的H2SO4溶液溶于水配置成500mL溶液,求溶液中H+的物质的量浓度.
H2SO4的物质的量为0.01L×18mol/L=0.18mol,
则n(H+)=2(H2SO4)=2×0.18mol=0.36mol,
配置成500mL溶液,溶液体积为500mL=0.5L,
故溶液中H+的物质的量浓度为
=0.72mol/L,
答:溶液中H+的物质的量浓度为0.72mol/L.
则n(H+)=2(H2SO4)=2×0.18mol=0.36mol,
配置成500mL溶液,溶液体积为500mL=0.5L,
故溶液中H+的物质的量浓度为
| 0.36mol |
| 0.5L |
答:溶液中H+的物质的量浓度为0.72mol/L.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目