题目内容
下列叙述正确的是( )
| A.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
| B.c(H+)=c(OH-)=1×10-6mol/L溶液一定呈中性 |
C.pH=5的H2SO4的溶液稀释500倍以后,溶液中的c(H+):c(SO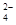 )=2:1 )=2:1 |
| D.0.1 mol·L-1 CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
B
试题分析:水的离子积常数只与温度有关系,所以选项A不正确,Kw不变。只要溶液中c(H+)=c(OH-),则该溶液就一点显中性,B正确;pH=5的H2SO4的溶液稀释500倍以后,溶液中pH=7,所以溶液中的c(H+):c(SO
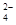 )=10:1,C不正确;醋酸钠溶于水,水解溶液显碱性,则c(Na+)>c(CH3COO-)>c(OH-) >c(H+),D不正确,答案选D。
)=10:1,C不正确;醋酸钠溶于水,水解溶液显碱性,则c(Na+)>c(CH3COO-)>c(OH-) >c(H+),D不正确,答案选D。点评:该题是中等难度的试题,试题难易适中,注重答题的灵活性。有利于培养学生的逻辑推理能力和灵活应变能力。该题的易错点是选项C,酸碱在无限稀释时,必须考虑到水的电离平衡。

练习册系列答案
相关题目
 Q 达到限度的标志是( )
Q 达到限度的标志是( ) 、Cl-
、Cl-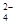 、H+、Ba2+、Cl-
、H+、Ba2+、Cl-