题目内容
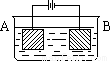
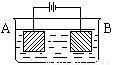
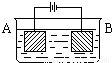
按右图的装置进行电解实验:A极是铜锌合金,B极为纯铜,电解质中含有足量的铜离子。通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68克,溶液质量增加0.03克,则A合金中Cu、Zn原子个数比为
| A. 4︰1 | B.3︰1 | C. 2︰1 | D.任意比 |
B
解析试题分析:从装置中看A电极是阳极,B 电极是阴极,锌比铜活泼,优先铜放电,然后铜再放电。反应过程 阳极:Zn-2e=Zn2+ { Cu-2e=Cu2+
{ 阴极:Cu2+ +2e=Cu Cu2+ +2e=Cu
第一个阶段,溶液质量增加,第二阶段溶液质量不变;
设合金中铜锌的物质的量分别是x y,所以由电子转移守恒可得
{65x-64y=0.03
64(x+y)=7.68 所以可得y/x = 3︰1 。
故选B。
考点:电解池的电极反应计算
点评:电解池:
A.电解池是在外电源作用下工作的装置.电解池中与电源负极相连的一极为阴极,阳离子在该极接受电子被还原;与电源正极相连的一极为阳极,阴离子或电极本身(对电镀而言)在该极失去电子被氧化。
B.电解池(或电镀池)中,根据反应现象可推断出电极名称.凡发生氧化的一极必为阳极,凡发生还原的一极必为阴极.例如用碳棒做两极电解溶液,析出Cu的一极必为阴极;放出的一极必为阳极。
注意:电解池中,与外电源正极相连的为阳极,与负极相连的为阴极,这一点与原电池的负对阳,正对阴恰恰相反。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
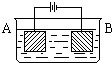 按右图的装置进行电解实验:A极是铜锌合金,B极为纯铜,电解质中含有足量的铜离子.通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.03g,则A合金中Cu、Zn原子个数比为( )
按右图的装置进行电解实验:A极是铜锌合金,B极为纯铜,电解质中含有足量的铜离子.通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.03g,则A合金中Cu、Zn原子个数比为( )