题目内容
(15分)银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:

(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,阴极反应式为 ;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为 。
(2)固体混合物B的组成为 ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为 。
(3)完成煅烧过程中一个反应的化学方程式: CuO+ Al2O3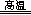 CuAlO2 + ↑。
CuAlO2 + ↑。
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0mol?L—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是 、过滤、洗涤和干燥。

(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,阴极反应式为 ;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为 。
(2)固体混合物B的组成为 ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为 。
(3)完成煅烧过程中一个反应的化学方程式: CuO+ Al2O3
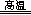 CuAlO2 + ↑。
CuAlO2 + ↑。(4)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0mol?L—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是 、过滤、洗涤和干燥。
(1)Ag++e-==Ag(1分) 2NO+O2==2NO2(2分)
(2)CuO和Al(OH)3(2分) Al(OH)3+OH-==AlO2-+2H2O或Al(OH)3+OH-==[Al(OH)4]-(2分)
(3)4 CuO+2 Al2O3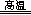 4 CuAlO2 +O2↑(2分)
4 CuAlO2 +O2↑(2分)
(4)50(2分) 25(2分)
(5)蒸发浓缩、冷却结晶(2分)
(2)CuO和Al(OH)3(2分) Al(OH)3+OH-==AlO2-+2H2O或Al(OH)3+OH-==[Al(OH)4]-(2分)
(3)4 CuO+2 Al2O3
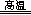 4 CuAlO2 +O2↑(2分)
4 CuAlO2 +O2↑(2分)(4)50(2分) 25(2分)
(5)蒸发浓缩、冷却结晶(2分)
(1)电解精炼铜时,纯铜作阴极,粗铜作阳极,硫酸铜溶液作电解液,电解精炼银与此类似,则纯银作阴极,粗银作阳极,硝酸银溶液作电解液,阳极主要反应式为Ag—e-==Ag+,阴极反应式为Ag++e-==Ag;银是金属活动顺序表中氢后金属,不溶于稀硫酸,因为稀硫酸是非氧化性酸,则滤渣A的主要成分是Ag,稀硝酸是氧化性酸,能溶解银、产生无色气体,即3Ag+4HNO3(稀)===3AgNO3+NO↑+2H2O,无色的一氧化氮气体在空气迅速被氧化为红棕色的二氧化氮气体,即2NO+O2==2NO2;(2)CuAlO2中氧为—2价,铝为+3价,则铜为+1价,因此其化学式也可以写为Cu2O?Al2O3,相当于氧化亚铜和氧化铝按物质的量之比为1∶1熔合在一起,由此逆推,固体B的主要成分是物质的量之比为1∶1的Al(OH)3和CuO,因为Cu(OH)2开始分解的温度为80℃,水的沸点大于80℃,则煮沸前后发生的反应为Al3++3OH-==Al(OH)3↓、Cu2++2OH-==Cu(OH)2↓、Cu(OH)2 CuO+H2O,由于Al(OH)3开始分解的温度为450℃,在惰性气体中煅烧时发生的反应为2Al(OH)3
CuO+H2O,由于Al(OH)3开始分解的温度为450℃,在惰性气体中煅烧时发生的反应为2Al(OH)3 Al2O3+3H2O、4CuO
Al2O3+3H2O、4CuO 2Cu2O+O2↑;氢氧化铝是两性氢氧化物,NaOH是强碱,若强碱溶液过量,则过量的NaOH能溶解部分或全部氢氧化铝,其离子方程式为Al(OH)3+OH-==AlO2-+2H2O或Al(OH)3+OH-==[Al(OH)4]-,这将导致目标产物产量的减少;(3)根据氧化还原反应的特征推断,铜元素由+2价降为+1价,铝元素化合价不变,由此推断反应前后升价元素一定是氧,且化合价由—2价升为相邻的0价,即缺少的生成物为氧气;根据化合价升降法配平可得:4CuO+2Al2O3
2Cu2O+O2↑;氢氧化铝是两性氢氧化物,NaOH是强碱,若强碱溶液过量,则过量的NaOH能溶解部分或全部氢氧化铝,其离子方程式为Al(OH)3+OH-==AlO2-+2H2O或Al(OH)3+OH-==[Al(OH)4]-,这将导致目标产物产量的减少;(3)根据氧化还原反应的特征推断,铜元素由+2价降为+1价,铝元素化合价不变,由此推断反应前后升价元素一定是氧,且化合价由—2价升为相邻的0价,即缺少的生成物为氧气;根据化合价升降法配平可得:4CuO+2Al2O3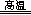 4CuAlO2+O2↑(或者根据设1法配平,先设反应物中氧化铝的系数为1,根据铝守恒可得生成物CuAlO2的系数为2,根据铜守恒可得反应物CuO的系数为2,根据氧守恒可得氧气的系数为1/2,即2CuO+1Al2O3
4CuAlO2+O2↑(或者根据设1法配平,先设反应物中氧化铝的系数为1,根据铝守恒可得生成物CuAlO2的系数为2,根据铜守恒可得反应物CuO的系数为2,根据氧守恒可得氧气的系数为1/2,即2CuO+1Al2O3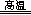 2CuAlO2+1/2O2↑,系数加倍后即可得到4CuO+2Al2O3
2CuAlO2+1/2O2↑,系数加倍后即可得到4CuO+2Al2O3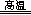 4CuAlO2+O2↑);(4)5.0kg=5.0×103g,银铜合金废料中铜的质量为5.0×103g×63.5%,铜元素的相对原子质量为63.5,由m/M=n可求铜的物质的量为5.0×103g×63.5%÷63.5g/mol=50mol,根据铜守恒可得转化关系式:Cu~CuAlO2,其中CuAlO2与Cu的物质的量之比等于系数之比,则铜完全转化可以变为50mol CuAlO2;根据铝守恒可得转化关系式:Al2(SO4)3~2CuAlO2,其中Al2(SO4)3与CuAlO2的物质的量之比等于系数之比,则至少需要25mol Al2(SO4)3;由V=n/c可求至少需要硫酸铝溶液的体积为25mol÷1.0mol/L=25L;(5)胆矾的化学式为CuSO4?5H2O,是硫酸铜溶液结晶析出的结晶水化合物,根据混合物分离和提纯的方法推断,从硫酸铜溶液中得到胆矾的基本操作是蒸发浓缩、冷却结晶、过滤、洗涤和干燥。
4CuAlO2+O2↑);(4)5.0kg=5.0×103g,银铜合金废料中铜的质量为5.0×103g×63.5%,铜元素的相对原子质量为63.5,由m/M=n可求铜的物质的量为5.0×103g×63.5%÷63.5g/mol=50mol,根据铜守恒可得转化关系式:Cu~CuAlO2,其中CuAlO2与Cu的物质的量之比等于系数之比,则铜完全转化可以变为50mol CuAlO2;根据铝守恒可得转化关系式:Al2(SO4)3~2CuAlO2,其中Al2(SO4)3与CuAlO2的物质的量之比等于系数之比,则至少需要25mol Al2(SO4)3;由V=n/c可求至少需要硫酸铝溶液的体积为25mol÷1.0mol/L=25L;(5)胆矾的化学式为CuSO4?5H2O,是硫酸铜溶液结晶析出的结晶水化合物,根据混合物分离和提纯的方法推断,从硫酸铜溶液中得到胆矾的基本操作是蒸发浓缩、冷却结晶、过滤、洗涤和干燥。
本题以从切割废料中回收银并制备铜化工产品的工艺为背景,结合给出的工艺流程图进行设问,主要考查了考生对常见金属、非金属元素及其化合物的主要性质的掌握,对常见化学方程式和离子方程式的书写,对电解池的组成和电解过程的理解,以及对工艺流程图的解读和所提供数据的应用等,并以此达到考查考生应用基础知识解决化学问题的能力;通过设计的工艺流程图设问,着重考查考生对Ag、Cu、Al、N等元素的相关化合物性质的掌握程度;考查考生对物质的量、摩尔质量、质量、物质的量浓度等概念的了解;考查考生对质量守恒定律的了解;考查考生根据物质的量、质量、物质的量浓度之间的相互关系进行有关计算的能力;考查考生对蒸发浓缩、冷却结晶、过滤、洗涤、干燥等基本实验操作的掌握。
 CuO+H2O,由于Al(OH)3开始分解的温度为450℃,在惰性气体中煅烧时发生的反应为2Al(OH)3
CuO+H2O,由于Al(OH)3开始分解的温度为450℃,在惰性气体中煅烧时发生的反应为2Al(OH)3 Al2O3+3H2O、4CuO
Al2O3+3H2O、4CuO 2Cu2O+O2↑;氢氧化铝是两性氢氧化物,NaOH是强碱,若强碱溶液过量,则过量的NaOH能溶解部分或全部氢氧化铝,其离子方程式为Al(OH)3+OH-==AlO2-+2H2O或Al(OH)3+OH-==[Al(OH)4]-,这将导致目标产物产量的减少;(3)根据氧化还原反应的特征推断,铜元素由+2价降为+1价,铝元素化合价不变,由此推断反应前后升价元素一定是氧,且化合价由—2价升为相邻的0价,即缺少的生成物为氧气;根据化合价升降法配平可得:4CuO+2Al2O3
2Cu2O+O2↑;氢氧化铝是两性氢氧化物,NaOH是强碱,若强碱溶液过量,则过量的NaOH能溶解部分或全部氢氧化铝,其离子方程式为Al(OH)3+OH-==AlO2-+2H2O或Al(OH)3+OH-==[Al(OH)4]-,这将导致目标产物产量的减少;(3)根据氧化还原反应的特征推断,铜元素由+2价降为+1价,铝元素化合价不变,由此推断反应前后升价元素一定是氧,且化合价由—2价升为相邻的0价,即缺少的生成物为氧气;根据化合价升降法配平可得:4CuO+2Al2O3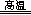 4CuAlO2+O2↑(或者根据设1法配平,先设反应物中氧化铝的系数为1,根据铝守恒可得生成物CuAlO2的系数为2,根据铜守恒可得反应物CuO的系数为2,根据氧守恒可得氧气的系数为1/2,即2CuO+1Al2O3
4CuAlO2+O2↑(或者根据设1法配平,先设反应物中氧化铝的系数为1,根据铝守恒可得生成物CuAlO2的系数为2,根据铜守恒可得反应物CuO的系数为2,根据氧守恒可得氧气的系数为1/2,即2CuO+1Al2O3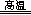 2CuAlO2+1/2O2↑,系数加倍后即可得到4CuO+2Al2O3
2CuAlO2+1/2O2↑,系数加倍后即可得到4CuO+2Al2O3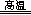 4CuAlO2+O2↑);(4)5.0kg=5.0×103g,银铜合金废料中铜的质量为5.0×103g×63.5%,铜元素的相对原子质量为63.5,由m/M=n可求铜的物质的量为5.0×103g×63.5%÷63.5g/mol=50mol,根据铜守恒可得转化关系式:Cu~CuAlO2,其中CuAlO2与Cu的物质的量之比等于系数之比,则铜完全转化可以变为50mol CuAlO2;根据铝守恒可得转化关系式:Al2(SO4)3~2CuAlO2,其中Al2(SO4)3与CuAlO2的物质的量之比等于系数之比,则至少需要25mol Al2(SO4)3;由V=n/c可求至少需要硫酸铝溶液的体积为25mol÷1.0mol/L=25L;(5)胆矾的化学式为CuSO4?5H2O,是硫酸铜溶液结晶析出的结晶水化合物,根据混合物分离和提纯的方法推断,从硫酸铜溶液中得到胆矾的基本操作是蒸发浓缩、冷却结晶、过滤、洗涤和干燥。
4CuAlO2+O2↑);(4)5.0kg=5.0×103g,银铜合金废料中铜的质量为5.0×103g×63.5%,铜元素的相对原子质量为63.5,由m/M=n可求铜的物质的量为5.0×103g×63.5%÷63.5g/mol=50mol,根据铜守恒可得转化关系式:Cu~CuAlO2,其中CuAlO2与Cu的物质的量之比等于系数之比,则铜完全转化可以变为50mol CuAlO2;根据铝守恒可得转化关系式:Al2(SO4)3~2CuAlO2,其中Al2(SO4)3与CuAlO2的物质的量之比等于系数之比,则至少需要25mol Al2(SO4)3;由V=n/c可求至少需要硫酸铝溶液的体积为25mol÷1.0mol/L=25L;(5)胆矾的化学式为CuSO4?5H2O,是硫酸铜溶液结晶析出的结晶水化合物,根据混合物分离和提纯的方法推断,从硫酸铜溶液中得到胆矾的基本操作是蒸发浓缩、冷却结晶、过滤、洗涤和干燥。本题以从切割废料中回收银并制备铜化工产品的工艺为背景,结合给出的工艺流程图进行设问,主要考查了考生对常见金属、非金属元素及其化合物的主要性质的掌握,对常见化学方程式和离子方程式的书写,对电解池的组成和电解过程的理解,以及对工艺流程图的解读和所提供数据的应用等,并以此达到考查考生应用基础知识解决化学问题的能力;通过设计的工艺流程图设问,着重考查考生对Ag、Cu、Al、N等元素的相关化合物性质的掌握程度;考查考生对物质的量、摩尔质量、质量、物质的量浓度等概念的了解;考查考生对质量守恒定律的了解;考查考生根据物质的量、质量、物质的量浓度之间的相互关系进行有关计算的能力;考查考生对蒸发浓缩、冷却结晶、过滤、洗涤、干燥等基本实验操作的掌握。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 6Cu+SO2↑,该反应的氧化剂是
6Cu+SO2↑,该反应的氧化剂是