题目内容
 如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )分析:原子半径:Z>W>X>Y.气态氢化物的稳定性:Y>X>W>Z.若Z为Na,则W为Mg,注意ⅡA族后面是过渡金属,不是ⅢA族元素,D不正确.题中的X、Y、Z、W对应的元素有3种可能:C、N、Al、Si;N、O、Si、P;O、F、P、S.
解答:解:A.根据同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大,则原子半径:Z>W>X>Y,故A错误;
B.根据同周期元素从左到右非金属性逐渐增强,同主族元素从上到下元素的非金属性逐渐减弱,且元素的非金属性越强,对应氢化物的稳定性越大,则气态氢化物的稳定性:Y>X>W>Z,故B错误;
C.如W为Si,则四种元素分别为C、N、Al、Si,W的最高正化合价与负化合价的绝对值相等,故C正确;
D.X、Y、Z、W对应的元素有3种可能:C、N、Al、Si;N、O、Si、P;O、F、P、S,Z的最高价氧化物的水化物可能为:
Al(OH)3、H2SiO3、H3PO4,则Z的最高价氧化物的水化物为弱碱或弱酸,故D错误.
故选C.
B.根据同周期元素从左到右非金属性逐渐增强,同主族元素从上到下元素的非金属性逐渐减弱,且元素的非金属性越强,对应氢化物的稳定性越大,则气态氢化物的稳定性:Y>X>W>Z,故B错误;
C.如W为Si,则四种元素分别为C、N、Al、Si,W的最高正化合价与负化合价的绝对值相等,故C正确;
D.X、Y、Z、W对应的元素有3种可能:C、N、Al、Si;N、O、Si、P;O、F、P、S,Z的最高价氧化物的水化物可能为:
Al(OH)3、H2SiO3、H3PO4,则Z的最高价氧化物的水化物为弱碱或弱酸,故D错误.
故选C.
点评:本题考查位置结构性质的相互关系应用,题目难度中等,D为易错点,注意若Z为Na,则W为Mg,注意ⅡA族后面是过渡金属,与ⅢA族元素不相邻.

练习册系列答案
相关题目
如图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( )
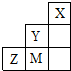
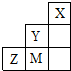
| A、离子半径:M->Z2->Y- | B、Z元素形成的氧化物都是共价化合物 | C、气态氢化物稳定性:Y>Z>M | D、三种元素中,M的最高价氧化物对应的水化物酸性最强 |
如图为元素周期表中短周期的一部分,下列说法错误的是( )
| X | Y |
| Z | W |
| A、Z的原子序数可能是X的两倍 |
| B、单质的活泼性可能是Y<Z |
| C、X、Z的最高价氧化物对应水化物可能均为强酸 |
| D、分别由Y、W形成的单质可能都是原子晶体 |
 (2013?佛山一模)如图为元素周期表中短周期的一部分,下列说法不正确的是( )
(2013?佛山一模)如图为元素周期表中短周期的一部分,下列说法不正确的是( ) (2010?武汉模拟)如图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( )
(2010?武汉模拟)如图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( )