题目内容
【题目】将一定体积密度为1.32g/cm3的硫酸溶液逐滴滴入到BaCl2溶液中,直到沉淀恰好完全为止。已知反应后所得溶液的质量等于原BaCl2溶液的质量,则原硫酸溶液浓度约为( )
A. 23.9% B. 11.0% C. 13.5mol/L D. 5.67mol/L
【答案】D
【解析】由题意,反应后所得溶液的质量=原BaCl2溶液的质量,由此可知:硫酸溶液的质量=硫酸钡的质量;设硫酸钡的质量为a g,则硫酸溶液的质量为a g,设硫酸溶液中溶质的质量是x,则:
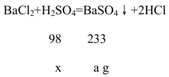
解得x=![]() g,所以硫酸溶液中溶质的质量分数是
g,所以硫酸溶液中溶质的质量分数是![]() ÷a×100%≈42.1%;硫酸的物质的量为
÷a×100%≈42.1%;硫酸的物质的量为![]() g÷98g/mol=
g÷98g/mol=![]() mol,硫酸溶液的体积为a g÷1.32g/cm3=
mol,硫酸溶液的体积为a g÷1.32g/cm3=![]() cm3,根据c=n/V=
cm3,根据c=n/V=![]() mol÷(
mol÷(![]() ×10-3 L),解得原硫酸溶液浓度约为5.67mol/L。故选D。
×10-3 L),解得原硫酸溶液浓度约为5.67mol/L。故选D。

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目



