题目内容
下列根据实验操作和现象所得出的结论不正确的是 ( )
| 选项 | 实验操作 | 实验现象 | 结 论 |
| A | 测定等浓度的Na2CO3和Na2SO3 溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
| B | SO2通入酸性高锰酸钾溶液 | 高锰酸钾溶液褪色 | SO2具有还原性 |
| C | 溴乙烷与NaOH溶液共热后,加HNO3酸化的AgNO3溶液 | 出现淡黄色沉淀 | 溴乙烷发生了水解 |
| D | 向等浓度的KBr、KI混合液中滴加AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgBr)>Ksp(AgI) |
A
试题分析:A.元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强。最高价氧化物对应的水化物的酸性就越强,相应的钠盐溶液的碱性也就越弱。所以应该比较等浓度的Na2CO3和Na2SO4 溶液的pH的大小。Na2SO3不是S的最高价氧化物对应的水化物的钠盐。错误。B. SO2通入酸性高锰酸钾溶液中,高锰酸钾溶液褪色是因为发生反应:5SO2+2H2O+2MnO4-=2Mn2++5SO42-+4H+.体现了SO2的还原性。正确。C.溴乙烷与NaOH溶液共热后,发生反应CH3CH2Br+NaOH
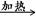 CH3CH2OH+NaBr。再加入HNO3酸化的AgNO3溶液时发生Br-+Ag+=AgBr↓。证明溴乙烷在NaOH的水溶液中发生了水解反应。正确。D.物质越难溶,反应产生沉淀所需要的离子的浓度就越小,就越先反应得到沉淀。Br-+Ag+=AgBr↓;AgBr是淡黄色沉淀,I-+Ag+=AgI↓,AgI是黄色沉淀。向等浓度的KBr、KI混合液中滴加AgNO3溶液,先出现黄色沉淀说明先发生反应I-+Ag+=AgI↓。因此Ksp(AgBr)>Ksp(AgI)。正确。2、溴乙烷的化学性质的知识。
CH3CH2OH+NaBr。再加入HNO3酸化的AgNO3溶液时发生Br-+Ag+=AgBr↓。证明溴乙烷在NaOH的水溶液中发生了水解反应。正确。D.物质越难溶,反应产生沉淀所需要的离子的浓度就越小,就越先反应得到沉淀。Br-+Ag+=AgBr↓;AgBr是淡黄色沉淀,I-+Ag+=AgI↓,AgI是黄色沉淀。向等浓度的KBr、KI混合液中滴加AgNO3溶液,先出现黄色沉淀说明先发生反应I-+Ag+=AgI↓。因此Ksp(AgBr)>Ksp(AgI)。正确。2、溴乙烷的化学性质的知识。
练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
