��Ŀ����
����Ŀ��SnSO4��һ����Ҫ�������Σ��ڹ�ҵ���������Ź㷺��Ӧ�ã����Ʊ�·�����£� 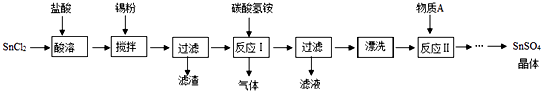
��֪�������������£���Һ�е�Sn2+�ɱ������е�����������Sn4+�� SnCl2��ˮ�����ɼ�ʽ�Ȼ�����[Sn��OH��Cl]��
��1��д������A�����ƣ� ��
��2��SnCl2�����������ˮ�ܽ��ԭ�������û�ѧ����ʽ��ʾ����
��3�����۵������dz�ȥ����ʱ����������Sn4+ �� ��д������Sn4+�����ӷ���ʽ�� ��
��4����Ӧ�����ɵij���ΪSnO��д���÷�Ӧ�Ļ�ѧ����ʽ�����÷�Ӧ���¶���Ҫ������75�����ҵ�ԭ���� ��
��5��ʵ�����С�Ưϴ��������ʵ���������������μ����Ƿ�Ưϴ�ɾ�
���𰸡�
��1������
��2��2Sn2++O2+4H+�T2Sn4++2H2O
��3��2Sn2++O2+4H+�T2Sn4++2H2O
��4��SnCl2+2NH4HCO3�TSnO��+2CO2��+2NH4Cl+H2O���¶Ƚϵ�ʱ��Ӧ����С���¶Ƚϸ�ʱ̼����炙�ֽ�
��5�����ز���������©��������������м�����ˮ����û�����������ã���ˮȫ���������ظ�����2��3�Σ�ȡ���һ��ƯϴҺ1��2mL���Թ��У��μ������ữ��AgNO3 �� ��������ɫ������˵��û��Ưϴ�ɾ�����֮Ưϴ�ɾ�
���������⣺SnCl2���������ܽ⣬���ּ���������Ҫ�Ƿ�ֹ���ܽ�ʱˮ��ͱ������������������ڹ��˳����ۣ��õ�SnCl2��Һ�ڷ�Ӧ����̼����立�Ӧ����SnO���Ȼ�李�������̼��ˮ���ٹ��˵õ�SnO����������Ưϴ��ȥ������������ӣ����ڷ�Ӧ���������ᷴӦ����SnSO4 �� ��һ���������յõ�SnSO4���壬��1�����ݷ�����֪��SnO������A��Ӧ����SnSO4 �� ��AΪ���ᣬ ���Դ��ǣ������2��SnCl2��ˮ�����ɼ�ʽ�Ȼ�����������ƽ��Sn Cl2+H2OSn��OH��Cl+HCl���������ᣬʹ��ƽ�������ƶ�������Sn2+ˮ�⣬
�ʴ��ǣ�SnCl2+H2OSn��OH��Cl+HCl����3�����������£�SnCl2���Ա������е�������������Sn2+����ΪSn4+ �� ��������ԭΪˮ����Ӧ���ӷ���ʽΪ��2Sn2++O2+4H+�T2Sn4++2H2O��
���Դ��ǣ�2Sn2++O2+4H+�T2Sn4++2H2O����4����Ӧ��õ�������SnO��SnԪ�ػ��ϼ�û�б仯�����ڷ�������ԭ��Ӧ��ͬʱ�������壬������Ϊ������̼����ѧ����ʽΪ��SnCl2+2NH4HCO3�TSnO��+2CO2��+2NH4Cl+H2O���¶Ƚϵ�ʱ��Ӧ����С���¶Ƚϸ�ʱ̼����炙�ֽ⣬
���Դ��ǣ�SnCl2+2NH4HCO3�TSnO��+2CO2��+2NH4Cl+H2O���¶Ƚϵ�ʱ��Ӧ����С���¶Ƚϸ�ʱ̼����炙�ֽ⣻��5��ʵ�����С�Ưϴ�������ķ����ǣ����ز���������©��������������м�����ˮ����û�����������ã���ˮȫ���������ظ�����2��3�Σ�
ƯϴҺ�������������ӣ���ϴ�Ӳ��ɾ������Լ����Ƿ�Ưϴ�ɾ��IJ�������Ϊ��ȡ���һ��ƯϴҺ1��2mL���Թ��У��μ������ữ��AgNO3 �� ��������ɫ������˵��û��Ưϴ�ɾ�����֮Ưϴ�ɾ���
���Դ��ǣ����ز���������©��������������м�����ˮ����û�����������ã���ˮȫ���������ظ�����2��3�Σ�ȡ���һ��ƯϴҺ1��2mL���Թ��У��μ������ữ��AgNO3 �� ��������ɫ������˵��û��Ưϴ�ɾ�����֮Ưϴ�ɾ���

����Ŀ����ͼ��ʾ��X,Y�ֱ���ֱ����Դ��������ͨ�����a�����������ӣ�b���崦����ɫ��ζ������ų���������һ������ǣ� �� 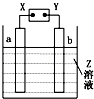
a���� | b���� | X�缫 | Z | |
A | п | ʯī | ���� | CuSO4 |
B | ʯī | ʯī | ���� | NaOH |
C | �� | �� | ���� | AgNO3 |
D | ͭ | ʯī | ���� | CuCl2 |
A.A
B.B
C.C
D.D
����Ŀ������β�����ŷŵ�NxOy��CO����ѧ��Ѱ�Ҹ�Ч����ʵ�ִ�����Ⱦ��ת���� 2CO��g��+2NO��g��N2��g��+2CO2��g����H1
��1����֪��CO��ȼ���ȡ�H2=��283kJmoL��1 �� ���ֻ�ѧ���ļ����������£�
��ѧ�� | N��N�� | O=O�� | N |
����kJ/mol��1 | 945 | 498 | 630 |
��֪��N2��g��+O2��g��=2NO��g����H3 �� ��H1= ��
��2��CO�������KOH��Һ�й���ȼ�ϵ�أ�ʯīΪ�缫�������ŵ��������Һ������Ũ�ȴ�С˳��Ϊ c��K+����c��HCO3������c��OH������c��H+����c��CO32���������ķ�ӦʽΪ��
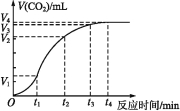
��3����һ���¶��£���2L���ܱ������г���4.0molNO2��4.0molCO���ڴ��������·�����Ӧ 4CO��g��+2NO2��g��N2��g��+4CO2��g����H��0������������£�
0min | 5min | 10min | 15min | 20min | |
c��NO2�� | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c��N2�� | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
��5��10min����CO��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ��
����˵��������Ӧ�ﵽƽ��״̬����
A��2n����NO2��=n����N2�� B����������ƽ����Է�����������
C�������ܶȲ���D������������ѹǿ����
��20minʱ���������м���1.0molNO2��1.0molCO����t1ʱ���ٴδﵽƽ��ʱ��NO2��ת���ʱ�ԭƽ��ʱ����������С�����䡱����
�ܼ�����¶��µĻ�ѧƽ�ⳣ��K=
��������ƽ��Ļ����ϣ���ʱ��t2��t3ʱ�ı䷴Ӧ��ijһ��������Ӧ���ʵı仯��ͼ��ʾ������t3ʱ�̸ı�ķ�Ӧ�����ǣ�����ʱ��15��20��t1��t2 �� t2��t3 �� t4��t5ʱ��ƽ�ⳣ���ֱ�ΪK1��K2��K3��K4 �� ��Ƚϸ�ƽ�ⳣ���Ĵ�С��ϵ�� ��