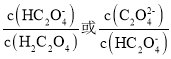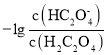题目内容
【题目】![]() 时,将一定量的冰醋酸
时,将一定量的冰醋酸![]() 即无水乙酸
即无水乙酸![]() 加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法正确的是
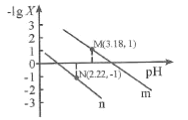
加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法正确的是![]()
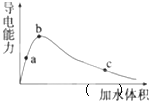
A.醋酸的电离平衡常数:![]()
B.溶液中![]() :
:![]()
C.a、b、c三点的溶液都有:![]()
D.从c点到b点,醋酸的电离度不断增大
【答案】C
【解析】
弱酸的电离常数只与温度有关,醋酸为弱电解,浓度越小,电离程度越大,对于该溶液,溶液导电能力越大,离子浓度越大,结合电荷守恒分析。
A.弱酸的电离常数只与温度有关,所以醋酸的电离平衡常数:![]() ,故A错误;
,故A错误;
B.加水稀释醋酸的电离程度增大,所以随着加水的体积,醋酸的电离程度增大,则![]() 增大,即溶液中
增大,即溶液中![]() :
:![]() ,故B错误;
,故B错误;
C.根据溶液的电荷守恒可知,a、b、c三点的溶液都有:![]() ,故C正确;
,故C正确;
D.从b点到c点,水的体积增大,溶液的浓度减小,电离度不断增大,故D错误;
答案选C。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案【题目】某兴趣小组同学进行乙醛的银镜反应实验的操作步骤如下:
A.在试管里先注入少量NaOH溶液,振荡,然后加热煮沸。把NaOH溶液倒去后,再用蒸馏水洗净试管备用。B.在洗净的试管里配制银氨溶液。C.沿试管壁加入乙醛稀溶液。D.加热。请回答下列问题:
(1)步骤A中加NaOH溶液振荡,加热煮沸的目是___。
(2)简述银氨溶液的配制过程:___。
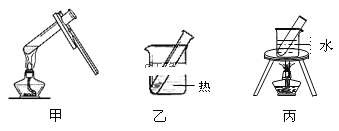
(3)步骤D应选择的加热方法是___(填下列装置编号),理由是___。
(4)乙醛发生银镜反应的化学方程式___。
(5)该兴趣小组的同学还对乙醛进行银镜反应的最佳实验条件进行了探究(部分实验数据如下表):
实验变量 实验序号 | 银氨溶液的量/mL | 乙醛的量/滴 | 温度/℃ | 反应混合液的pH | 出现银镜的时间/min |
1 | 1 | 3 | 65 | 11 | 5 |
2 | 1 | 3 | 45 | 11 | 6.5 |
3 | 1 | 5 | 65 | 11 | 4 |
①实验1和实验2,探究的是___。
②当银氨溶液的量为1mL,乙醛的量为3滴,温度为50℃,反应混合液pH为11时,出现银镜的时间___。(填范围)
③你认为探究乙醛进行银镜反应的最佳条件,除了测量银镜出现的时间外,还需要比较不同条件下形成银镜的___。
(6)银氨溶液放久后会产生氮化银而引起爆炸,直接排放会污染环境,且造成银资源的浪费。实验室从反应后的废液中回收银的实验流程如下:

已知:[Ag(NH3)2]![]() 在溶液中存在平衡:[Ag(NH3)2]+
在溶液中存在平衡:[Ag(NH3)2]+![]() Ag
Ag![]() +2NH3。
+2NH3。
①写出废液与稀HNO3反应的离子方程式___。
②加入的铁粉要过量的目的是___。
③该实验过程中可能产生的大气污染物是___。