题目内容
【题目】草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,170℃以上分解。常温下它的电离常数K1=5.4×10-2,K2=5.4×10-5。回答下列问题:
(1)查阅资料知:草酸晶体175℃分解成CO2、CO、H2O,请写出草酸晶体分解的化学反应方程式:_____。
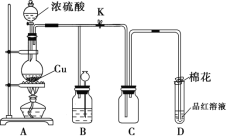
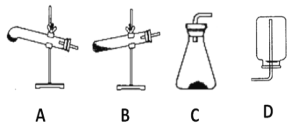
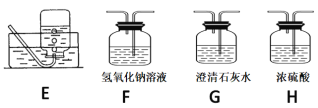
(2)请用下列的装置(图中加热装置已略去)分解草酸晶体以制备少量CO气体,最佳的连接顺序为:________。(填字母序号)
(3)设计实验证明草酸为弱酸的方案及其现象均正确的有_____________(填序号)。
A.室温下,测0.1mol/L的H2C2O4溶液与H2SO4溶液的pH,硫酸溶液的pH比草酸的小;
B.室温下,取pH=3的H2C2O4溶液稀释100倍后,测其pH<5;
C.标况下,取0.10mol/L的H2C2O4溶液100mL与足量锌粉反应,收集到H2体积为224mL。
(4)现需要配制900mL1mol/L的草酸溶液。
①需要的仪器有托盘天平(带砝码)、钥匙、烧杯、量筒、胶头滴管、_________、__________(填仪器名称)。
②下列操作会使所配溶液浓度偏低的是__________。(填字母)
A.称量时用了生锈的砝码
B.容量瓶未干燥即用来配制溶液
C.H2C2O4·2H2O晶体失去了部分结晶水
D.定容时,仰视刻度线
E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
(5)用草酸滴定KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数)。
①滴定过程中反应的离子方程式为_____________________________________________。
②量取KMnO4样品溶液应选用__________(填“酸式”或“碱式”)滴定管;若量取KMnO4样品溶液的滴定管用蒸馏水洗净后未润洗,则最终的测定结果将________(填“偏大”、“偏小”或“不变”)。
③现取KMnO4粗品10g,配成100mL溶液,取25.0 mL用(4)中配制的草酸溶液滴定,并进行3次平行实验,所用的草酸溶液的体积分别为23.00 mL、20.02 mL、19.98 mL,请问KMnO4粗品的质量分数为______________。(已知:KMnO4的摩尔质量为158g/mol)
【答案】H2C2O4·2H2O![]() CO↑+CO2↑ +3H2O↑A-F-G-EAB玻璃棒1000mL容量瓶DE2MnO4- +5H2C2O4 +6H+=2Mn2+ +10CO2↑+8H2O酸式偏小50.56%
CO↑+CO2↑ +3H2O↑A-F-G-EAB玻璃棒1000mL容量瓶DE2MnO4- +5H2C2O4 +6H+=2Mn2+ +10CO2↑+8H2O酸式偏小50.56%
【解析】
(1)草酸晶体的受热分解生成CO、CO2、水,根据得失电子守恒配平方程式;(2)给试管里的晶体加热时,为防止反应生成的水或所含结晶水在管口液化后倒流引起试管破裂,要求试管口要向下倾斜;为制备分解产物中的CO,先要排除已证明生成的CO2对实验的干扰,可用F装置吸收CO2气体,并利用G装置证明CO2已经除尽,最后用排水法收集CO;(3)证明草酸为弱酸需要证明溶液中存在电离平衡,弱酸形成的强碱弱酸盐是否水解或者与等浓度的强酸酸性强弱比较分析;(4) ①配制步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,用托盘天平称取草酸,在烧杯中溶解,并用玻璃棒搅拌,冷却后转移到1000mL容量瓶中,并用玻璃棒引流,洗涤烧杯与玻璃棒2~3次,并移入容量瓶内,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,盖好瓶塞,反复颠倒摇匀;②根据![]() 分析误差;(5)①用草酸滴定KMnO4溶液,高锰酸根离子被还原为锰离子、草酸被氧化为二氧化碳;②KMnO4具有氧化性,能腐蚀橡胶; 根据c(待测)=
分析误差;(5)①用草酸滴定KMnO4溶液,高锰酸根离子被还原为锰离子、草酸被氧化为二氧化碳;②KMnO4具有氧化性,能腐蚀橡胶; 根据c(待测)=![]() 分析误差;③3次平行实验,所用的草酸溶液的体积分别为23.00 mL、20.02 mL、19.98 mL,第一次实验消耗草酸溶液的体积偏离正常误差,根据第二次、第三次实验数据消耗草酸溶液的平均体积是20.00 mL,根据2MnO4- +5H2C2O4 +6H+=2Mn2+ +10CO2↑+8H2O计算高锰酸钾的纯度。
分析误差;③3次平行实验,所用的草酸溶液的体积分别为23.00 mL、20.02 mL、19.98 mL,第一次实验消耗草酸溶液的体积偏离正常误差,根据第二次、第三次实验数据消耗草酸溶液的平均体积是20.00 mL,根据2MnO4- +5H2C2O4 +6H+=2Mn2+ +10CO2↑+8H2O计算高锰酸钾的纯度。
(1)草酸晶体的受热分解生成CO、CO2、水,根据得失电子守恒,CO、CO2的比为1:1,方程式是H2C2O4·2H2O![]() CO↑+CO2↑ +3H2O↑;(2)给试管里的晶体加热时,为防止反应生成的水或所含结晶水在管口液化后倒流引起试管破裂,要求试管口要向下倾斜;为制备分解产物中的CO,先要排除已证明生成的CO2对实验的干扰,可用F装置吸收CO2气体,并利用G装置证明CO2已经除尽,最后用排水法收集CO,所以最佳的连接顺序为A-F-G-E;(3)A.室温下,测0.1mol/L的H2C2O4溶液与H2SO4溶液的pH,硫酸溶液的pH比草酸的小,说明草酸溶液中存在电离平衡,证明草酸是弱酸,故A正确; B.室温下,取pH=3的H2C2O4溶液稀释100倍后,测其pH<5,说明稀释促进电离,溶液中存在电离平衡,为弱酸,故B正确;C.标况下,取0.10mol/L的H2C2O4溶液100mL与足量锌粉反应,收集到H2体积为224mL,强酸和弱酸都符合,和强酸弱酸无关,故C错误;(4) ①配制步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,用托盘天平称取草酸,在烧杯中溶解,并用玻璃棒搅拌,冷却后转移到1000mL容量瓶中,并用玻璃棒引流,洗涤烧杯与玻璃棒2~3次,并移入容量瓶内,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,盖好瓶塞,反复颠倒摇匀;所以需要的仪器有托盘天平(带砝码)、钥匙、烧杯、量筒、胶头滴管、1000mL容量瓶。 ②A.称量时用了生锈的砝码,草酸物质的量偏大,会使所配溶液浓度偏高,故不选A; B.容量瓶未干燥即用来配制溶液,无影响,故不选B; C.H2C2O4·2H2O晶体失去了部分结晶水,草酸物质的量偏大,会使所配溶液浓度偏高,故不选C; D.定容时,仰视刻度线,溶液体积偏大,会使所配溶液浓度偏低,故选D; E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线,溶液体积偏大,使所配溶液浓度偏低,故选E。(5)①用草酸滴定KMnO4溶液,高锰酸根离子被还原为锰离子、草酸被氧化为二氧化碳,反应离子方程式是2MnO4- +5H2C2O4 +6H+=2Mn2+ +10CO2↑+8H2O;②KMnO4具有氧化性,能腐蚀橡胶,所以量取KMnO4样品溶液应选用酸式滴定管;若量取KMnO4样品溶液的滴定管用蒸馏水洗净后未润洗,造成高锰酸钾的物质的量偏小,消耗草酸的的体积偏小, 根据c(待测)=
CO↑+CO2↑ +3H2O↑;(2)给试管里的晶体加热时,为防止反应生成的水或所含结晶水在管口液化后倒流引起试管破裂,要求试管口要向下倾斜;为制备分解产物中的CO,先要排除已证明生成的CO2对实验的干扰,可用F装置吸收CO2气体,并利用G装置证明CO2已经除尽,最后用排水法收集CO,所以最佳的连接顺序为A-F-G-E;(3)A.室温下,测0.1mol/L的H2C2O4溶液与H2SO4溶液的pH,硫酸溶液的pH比草酸的小,说明草酸溶液中存在电离平衡,证明草酸是弱酸,故A正确; B.室温下,取pH=3的H2C2O4溶液稀释100倍后,测其pH<5,说明稀释促进电离,溶液中存在电离平衡,为弱酸,故B正确;C.标况下,取0.10mol/L的H2C2O4溶液100mL与足量锌粉反应,收集到H2体积为224mL,强酸和弱酸都符合,和强酸弱酸无关,故C错误;(4) ①配制步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,用托盘天平称取草酸,在烧杯中溶解,并用玻璃棒搅拌,冷却后转移到1000mL容量瓶中,并用玻璃棒引流,洗涤烧杯与玻璃棒2~3次,并移入容量瓶内,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,盖好瓶塞,反复颠倒摇匀;所以需要的仪器有托盘天平(带砝码)、钥匙、烧杯、量筒、胶头滴管、1000mL容量瓶。 ②A.称量时用了生锈的砝码,草酸物质的量偏大,会使所配溶液浓度偏高,故不选A; B.容量瓶未干燥即用来配制溶液,无影响,故不选B; C.H2C2O4·2H2O晶体失去了部分结晶水,草酸物质的量偏大,会使所配溶液浓度偏高,故不选C; D.定容时,仰视刻度线,溶液体积偏大,会使所配溶液浓度偏低,故选D; E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线,溶液体积偏大,使所配溶液浓度偏低,故选E。(5)①用草酸滴定KMnO4溶液,高锰酸根离子被还原为锰离子、草酸被氧化为二氧化碳,反应离子方程式是2MnO4- +5H2C2O4 +6H+=2Mn2+ +10CO2↑+8H2O;②KMnO4具有氧化性,能腐蚀橡胶,所以量取KMnO4样品溶液应选用酸式滴定管;若量取KMnO4样品溶液的滴定管用蒸馏水洗净后未润洗,造成高锰酸钾的物质的量偏小,消耗草酸的的体积偏小, 根据c(待测)=![]() ,最终的测定结果将偏小;③3次平行实验,所用的草酸溶液的体积分别为23.00 mL、20.02 mL、19.98 mL,第一次实验消耗草酸溶液的体积偏离正常误差,根据第二次、第三次实验数据消耗草酸溶液的平均体积是20.00 mL,设高锰酸钾的纯度为x%,
,最终的测定结果将偏小;③3次平行实验,所用的草酸溶液的体积分别为23.00 mL、20.02 mL、19.98 mL,第一次实验消耗草酸溶液的体积偏离正常误差,根据第二次、第三次实验数据消耗草酸溶液的平均体积是20.00 mL,设高锰酸钾的纯度为x%,
2MnO4- +5H2C2O4 +6H+=2Mn2+ +10CO2↑+8H2O
2 5
![]() 1mol/L
1mol/L![]() 0.02L
0.02L
X%=50.56%